本文作者:云也、阿黛勒
这是发在 Nature 子刊的一篇论文中,一位母亲为他 13 岁的孩子精心整理的病程记录 [1]:
1 个月,发现严重胃肠道症状和发育不全。
8 个月,第一次癫痫发作。
2 岁,由于癫痫症状发作频繁、迅速、难以控制,住进临终关怀病房。
在 9 个不同的医疗机构住院 29 次,被误诊 33 次,每天吃 12~15 种药,一天发一百次癫痫,大小便失禁……
这是全球唯一的患者——成为这样的唯一,是世间最大的不幸。
2 岁进临终病房,4 年误诊 33 次
最初,医生们对这个叫康纳的小患者最乐观的估计,是活到 4 岁。
或许这个估计,还包含着对母亲凯丽的宽慰,但凯丽比医生们想象的要执着千万倍。
她不仅没有放弃,还为此辗转各地遍寻名医,甚至自学起了癫痫相关的各种罕见疾病,试图跟死神赛跑,为孩子再争取一线生机。
这一跑,就是十年。[2]
或许是集齐了天时地利人和,当时正是基因组测序转向市场应用的关键时期,于是就在康纳 4 岁时,凯丽给康纳做上了外显子组测序。
经专家判读和筛查,康纳的病因找到了——SCN2A 基因上的一个新生突变。
此时的凯丽,认为痛苦终于到头了:
整个婴幼儿时期,康纳同时用药多达 12~15 种才堪堪能保命,生活质量根本无从谈起。除了癫痫密集发作,康纳还有严重的运动障碍、发育非常迟缓、生活不能自理;严重肠胃不适、大小便失禁;情绪异常,焦虑,对各种刺激反应过度……

凯丽与康纳 图源:参考资料 3
但没想到,确诊病因,带来的却是更深的绝望。
当时,别说临床医生,就是走在最前沿的遗传学家,也对 SCN2A 的功能和存在的突变类型知之甚少。
因此,虽然得到了具体测序结果(一个错义突变 R853Q,导致相应蛋白质上精氨酸被谷氨酰胺取代),但仍然没有人能够提供注释,解释这个突变究竟在脑子里造成了什么后果,治疗更无从谈起。
更重要的是,因为康纳是全球唯一发现这个突变的患者,如果为他开发药物,那么为了这个药投入的成本将只能供他一人使用,没有商业价值。
谁会当这个冤大头,投入高额成本,为一个人做一种药呢?[3]
全球唯一的患者,想治好要等 100 年?
于是,在告知凯丽康纳的明确诊断的同时,研究者对她直言:要拿到治疗这个病的药,或许得再等一百年。

凯丽与康纳 图源:参考资料 4
技术难度尚可解,但全球唯一患者更大的困境,是谁来做这个赔本买卖。美国 FDA 将罕见病定义为在美国影响少于 20 万人的疾病。相比之下,「孤儿病」的药物研究则更没有商业价值。
即便有了人类基因组计划和基因检测技术,但有条件诊断的机构依然少之又少,这些患者大多还是在一次次的误诊之后,病情恶化,最终死亡。
而且,纵然有幸被转诊到顶级医院,患者也要等待数年,才能获得一个毫无用处的基因名称,然后得知现在治不了,未来也不太可能有药可用。
就像凯丽说的:「在理解了疾病、制药和商业原理之后,我已经不相信有人会只为一个人创造一种药物。」
但凯丽的意志力真的超乎常人,倒了这一步她依然没有放弃。
她继续为了儿子学医,对前沿研究紧追不放,专有词汇都像该领域的专家一样倒背如流。
她甚至与另一个同样带有全球唯一突变的孩子的父母一起,联合创办了一家生物技术公司 RogCon Biosciences,自己做制药商为孩子造真正的「孤儿药」。
凯丽创办公司最终失败 图源:corporationwiki.com
但很可惜,她还是失败了,在研技术也被转让。
凯丽没有放弃,她依然在尝试各种维持康纳的生命,等待技术进步的脚步,希望孩子能熬到有药的那一天。
每一步都是绝望,直到康纳 10 岁时,凯丽再次见到了罕见病药物专家斯坦利·克鲁克。
这次是凯丽第二次见他,上一次见克鲁克时,作为 Ionis Pharmaceuticals 的 CEO 克鲁克还拒绝了她,理由就是患病率实在太小,无法在商业上进行。
但那次谈话之后,克鲁克却开始不断反问自己:明明技术上可行的,就因为没有商业价值,就真的不能救人了吗?[3]
克鲁克之所以能笃定技术上可行,是因为他所在的公司,已经花了几十年时间研究干扰致病蛋白质的反义寡核苷酸,就在 2016 年迎来了第一个突破,为曾经认为必死的脊髓性肌萎缩症(SMA)患儿成功研发了新疗法。
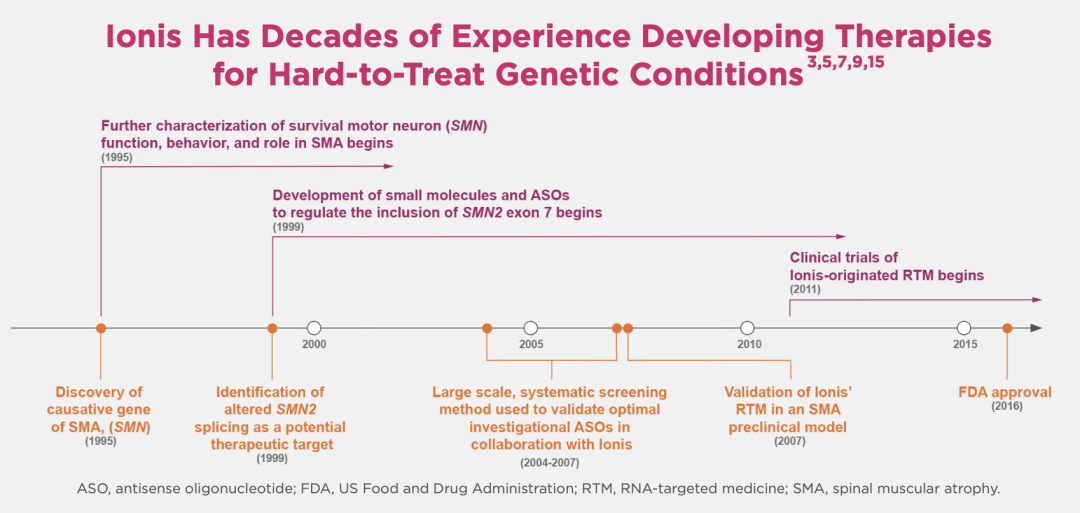
SMA ASO 药物研发历程 图源:Ionis 官网
该疗法属于「个性化 ASOs 治疗」。ASOs 是反义单链寡核苷酸,可以干扰 RNA 转录,抑制、还原或修饰蛋白质表达,可以作为一种基因治疗方法 [5]。
而随着在还有一定规模患者的罕见疾病上不断研究,ASO 平台随之成熟,流程化设计开始成为可能,可以应用于更多病种 [6]。
更重要的是,成本也开始降低,给公益救助提供了土壤。
重金研究只为 1 个患者,还能给医保省钱了?
就像克鲁克第一次拒绝凯丽时提到的,传统药物开发是浩大的工程,需要 5 年、10 年甚至更长时间,每年一两千万美元投入是必须的。
而 ASO 平台一边研发新药一边发展降低成本,是克鲁克成立 n-Lorem 公益基金会,赞助超罕见病药物开发的基础。
此时,超罕见疾病也终于确定了定义:全球影响不到 30 名患者的疾病。而全球唯一患者,是 n-Lorem 关注的最主要患者群体。

超罕见病徽章 图源:n-Lorem
于是,2021 年,康纳终于成为了该基金会救助的第一个孩子。
十年过去,全球已经报道了 9 例具有相同 SCN2A 基因突变的患者,他们表现出与康纳相似的症状,该基因的关键作用也开始为人所知 [7]。于是,在这些研究的基础上,针对康纳的药物研究进展比想象中的更加顺利。
2023 年 3 月,在圣地亚哥雷迪儿童医院,格里森医生终于给康纳完成了新药注射。
仅仅 3 针,康纳的癫痫发作几乎完全消失,甚至奇迹般地开始独立行走。
格里森都惊讶于如此低剂量药物就能带来如此神奇的疗效:「这给了我们很大的希望,这样做新药真的能救下这些独一无二的孩子。」
「对于刚满 15 岁的康纳来说,过去的时间已无法挽回,但他的未来终于有了希望。」
「即使成本降低后依然昂贵,但只要收益-风险比有利,我们就会终身免费这么做。」

药物研究团队 图源:n-Lorem
克鲁克和格里森同时强调,这也不仅是医者救人的情怀——即便算算经济账,一样是最优选择。
虽然每个患者可能都是独一无二的,但总数量也能达到数百万,以后被测出来的基因突变越来越多,患者只会更多。加上这些病通常很容易致死致残,又有超高的误诊率和维持治疗费用,家庭和社会的负担会很大 [1]。
「今天,所需的技术已经具备,康纳的成功就提供了一种模式,一边是人类未知领域的前沿探索,另一边是高临床转化节省数十亿美元的医疗保健费用,何尝不是一箭双雕。」
「根据现在的 ASO 策略,我们可以实现耗时一两年、仅花费 150 万美元就做出一种新药。」这是 n-Lorem 重要成员格拉斯博士,在刚刚举行的 2024 年美国世界孤儿药大会上对罕见病顾问委员提出的最新数字 [8]。
目前,还有 120 多名患者的药物正在开发,27 名患者的新药已经提交了个体化 ASO 的研究 IND 申请 [9]。
或许相比庞大的患者群体而言这还太少太少,但至少对于独一无二的孩子们,一线生机,正曙光初现。
策划:云也|监制:gyouza、carollero
编辑:ifhealth 来源:丁香园
