
2026 年 1 月 24 日至 25 日,由中国临床肿瘤学会(CSCO)肝癌专委会、CSCO 胆道肿瘤专委会和 CSCO 胰腺癌专委会,北京市希思科临床肿瘤学研究基金会、东方临床肿瘤研究中心(ECCO)、北京健康促进会联合丁香园共同主办的「2025 肝胆胰肿瘤年终盘点暨第 2 届临床热词发布会」,于上海宝华万豪酒店以线上线下同步形式隆重召开,七大医学领域专业媒体同步转播,共同见证了这一学术盛会的重磅发布,现场与线下观看人次高达 20 万。
本次大会由复旦大学附属中山医院樊嘉院士和周俭院士,中国药科大学附属上海高博肿瘤医院 / 南京天印山医院秦叔逵教授,海军军医大学第三附属医院(上海东方肝胆外科医院)沈锋教授,丁香园创始人李天天先生共同担任大会主席,汇聚肝胆胰肿瘤领域顶尖专家学者,共议前沿进展与临床实践,并重磅揭晓「2025 肝癌、胆道癌、胰腺癌年度临床热词、临床研究榜单及临床靶点榜单」,全面解读过去一年领域的重大突破,为临床诊疗提供权威指导与实践参考。
开幕式
2026 年 1 月 25 日,本次大会的关键环节正式拉开帷幕。开幕式首先进入「主席致辞」环节,由中国科学技术大学附属第一医院刘连新教授主持。会议伊始,大会主席秦叔逵教授、樊嘉院士、周俭院士、沈锋教授,以及丁香园创始人李天天先生进行精彩致辞。

大会主席秦叔逵教授致辞发言,向与会专家、学者及同仁致以欢迎与感谢,指出肝胆胰肿瘤威胁人类健康,我国肝癌发病形势严峻,胆道肿瘤与胰腺癌恶性程度高、预后差。他提及 CSCO 肝癌专委会、CSCO 胆道肿瘤专委会和 CSCO 胰腺癌专委会在推动诊疗规范化建设与多学科协作方面开展了一系列重要举措;我国学者在该领域科研成果有目共睹,多环节实现重要突破。他强调精准医学技术将促进肝胆胰肿瘤诊疗模式发生重大变革,本次会议的热词提炼、研究与靶点总结,正是这一重大变革的深刻体现。秦叔逵教授强调,本次大会的举办过程得到了 CSCO 媒体战略伙伴、大会共同主办方丁香园的大力支持与帮助,特此向各位支持本次大会的专业媒体、CSCO 团队会员伙伴表示衷心感谢,预祝本次会议取得圆满成功。

大会主席樊嘉院士致辞指出,肝胆胰肿瘤因高异质性、强侵袭性、低早期诊断率成为临床难题。在「健康中国 2030」战略下,我国该领域防治体系已实现从基础研究到临床转化、单学科到多学科协作的变革。本次会议锚定临床痛点提炼年度热词、聚焦前沿盘点十大进展、着眼未来布局发展方向,他强调中国学者需以原始创新破局,打破学科壁垒加速成果转化,实现从「跟跑」到「领跑」的跨越,期待会议成为交流桥梁与创新火种,预祝大会圆满成功。

大会主席周俭院士致辞指出,在「健康中国 2030」战略指引下,我国肝胆胰肿瘤领域诊疗与研究成果丰硕,国际话语权稳步提升。2025 年,肝癌围手术期靶免治疗突破传统局限,胆道肿瘤免疫联合化疗确立一线标准,胰腺癌肿瘤电场治疗开辟新路径。我国学者实现从「跟跑模仿」到「并跑引领」的跨越,原创研究填补国际空白,诊疗方案更贴合中国患者需求。他强调医者使命在肩,预祝大会圆满成功,祝愿同仁顺遂精进。

大会主席沈锋教授致辞中向与会专家、学者及临床工作者致以欢迎与感谢。他指出,过去一年肝胆胰肿瘤领域挑战与机遇并存,该类肿瘤异质性高、早期症状隐匿、易耐药复发,诊疗难度大。面对困境,领域同仁优化诊疗规范,推广多学科综合治疗模式,普及微创手术技术,成效显著。本次会议设热词揭榜、主题演讲、临床交流等环节,旨在总结学术进展、促进交流合作,期待同仁携手推动肝胆胰肿瘤防治水平提升,预祝大会圆满成功。

大会主席李天天先生发表致辞,向现场及线上嘉宾致以问候,他指出本次活动聚焦三大肿瘤领域,以发布年度临床热词、解读前沿议题、促进成果临床转化为核心目标;年度热词依托丁香园数据库,整合全球期刊、会议成果及专家反馈量化形成。作为深耕医疗领域 26 年的平台,丁香园打造学术交流生态,以人工智能平台赋能临床决策。他表示丁香园愿发挥平台优势,搭建产学研桥梁,凝聚行业智慧攻克诊疗难题,预祝活动圆满成功。

2025 年肝癌、胆道癌、胰腺癌临床热词揭榜
开幕式的第二个环节为重磅环节「临床热词揭榜」,本环节由中国香港大学深圳医院的潘宏铭教授主持。潘宏铭教授介绍了肝癌、胆道恶性肿瘤、胰腺癌榜单计算逻辑。本次年度临床热词评选采用加权计分法,综合三大核心维度科学筛选:国际重要学术会议成果占比 30%;核心期刊文献占比 50%,涵盖影响因子 ≥10 的国际医学肿瘤类期刊及国内重点专业期刊;丁香指数(临床从业者搜索频次数据)占比 20%,通过科学权重分配,精准遴选出年度临床热词。

在揭榜环节,首先,大会主席周俭院士重磅揭晓「2025 肝癌年度临床热词」。

2025 肝癌三大年度临床热词
双免治疗长生存获益
在晚期肝细胞癌(HCC)一线治疗领域,以 STRIDE 方案和「O+Y」方案为代表的双免疫治疗策略,持续刷新长期生存数据。NMPA 与 FDA 相继批准「O+Y」方案用于不可切除或晚期 HCC 成人患者一线治疗,这是目前中国唯一获批用于肝癌一线治疗的双免联合方案,为晚期肝癌患者点亮了长生存的希望。
钇-90 树脂微球获批新适应证
2025 年是钇 -90 适应证拓展的关键一年,国内外审批进程显著提速。7 月,远大医药钇-90 树脂微球产品获美国食品药品监督管理局(FDA)批准,新增不可切除肝细胞癌(HCC)治疗适应证,成为首个同时覆盖不可切除 HCC 与结直肠癌肝转移(CRLM)的选择性内放射治疗(SIRT)用钇 -90 微球产品。
围手术期靶免联合治疗突破
2025 年,肝癌围手术期治疗迎来重大突破。由中国研究者牵头的 CARES-009 研究首次证实,对于可切除 HCC,相较于单纯手术治疗,采用 「新辅助 + 手术 + 辅助」的「夹心饼模式 」,可使患者中位无事件生存期(EFS)数值翻倍(42.1 个月 vs 19.4 个月)。这一成果标志着中国早期肝癌研究成果推动全球肝癌围手术期治疗正式迈入靶免联合时代,为可切除肝癌患者带来了更优的治疗选择与希望。

2025 肝癌年度关注临床研究前五名
第五名:CheckMate 9DW(得分:95.00)
2024 年 ASCO 年会公布的结果显示,与仑伐替尼 / 索拉非尼单药对照组相比,纳武利尤单抗联合伊匹木单抗(O+Y)组中位总生存期(OS)近 2 年,2 年 OS 率提升 10%,客观缓解率(ORR)改善近 3 倍。基于此项研究,中国国家药品监督管理局(NMPA)先于 FDA 批准「O+Y」方案用于不可切除或晚期 HCC 成人患者一线治疗,标志着中国肝癌治疗正式迈入双免新时代。
第四名:TALENTOP(得分:96.00)
这是一项随机、对照、开放标签 Ⅲ 期临床研究,聚焦「经系统治疗后疾病得到控制的局部晚期 HCC 患者」这一特殊群体,创新性地将「T+A」方案用于 HCC 合并大血管侵犯患者的围手术期治疗。该研究首次用循证的方式说明:对于晚期不可切除的肝癌患者来说,系统治疗不仅可以带来成功的转化获益(手术机会),更可能带来长久、稳定的无瘤生存机会。
第三名:TREMENDOUS(得分:96.30)
该研究聚焦全球首个获批的双免联合方案(STRIDE),探索其在晚期不可切除 HCC 中国大陆人群中的疗效与安全性。中期分析结果显示,STRIDE 方案在国内患者中展现出与全球数据一致的卓越疗效,且安全性特征为中国患者长期用药提供了可靠保障。该结果与 HIMALAYA 研究长生存数据相互印证,进一步确认了 STRIDE 方案可为全球不可切除 HCC 患者带来显著生存获益。
第二名:CS1003-305(得分:96.50)
该项多中心、双盲、随机对照 Ⅲ 期临床试验研究旨在探索 PD-1 抑制剂 Nofazinlimab 联合仑伐替尼,对比安慰剂联合仑伐替尼一线治疗不可切除或转移性 HCC 的疗效与安全性。中位随访时长达 42.5 个月,尽管 PD-1 单抗联合仑伐替尼组中位 OS 较对照组未实现统计学显著延长,但其中位 OS 绝对值已成为晚期肝细胞癌 PD-1 单抗联合 TKI 一线治疗难以超越的「新标杆」。
第一名:CARES-009(得分:97.80)
该研究是全球首个由研究者发起、在肝癌围手术期治疗 Ⅲ 期研究中取得阳性结果的临床试验,实现了肝癌围手术期治疗领域的多项「全球首个」:中国团队首次在全球范围内定义了肝癌围手术期治疗的可行方案,将肝癌围手术期「三明治」式治疗从「概念」推向了「证据」,从「中国经验」走向了「全球方案」。

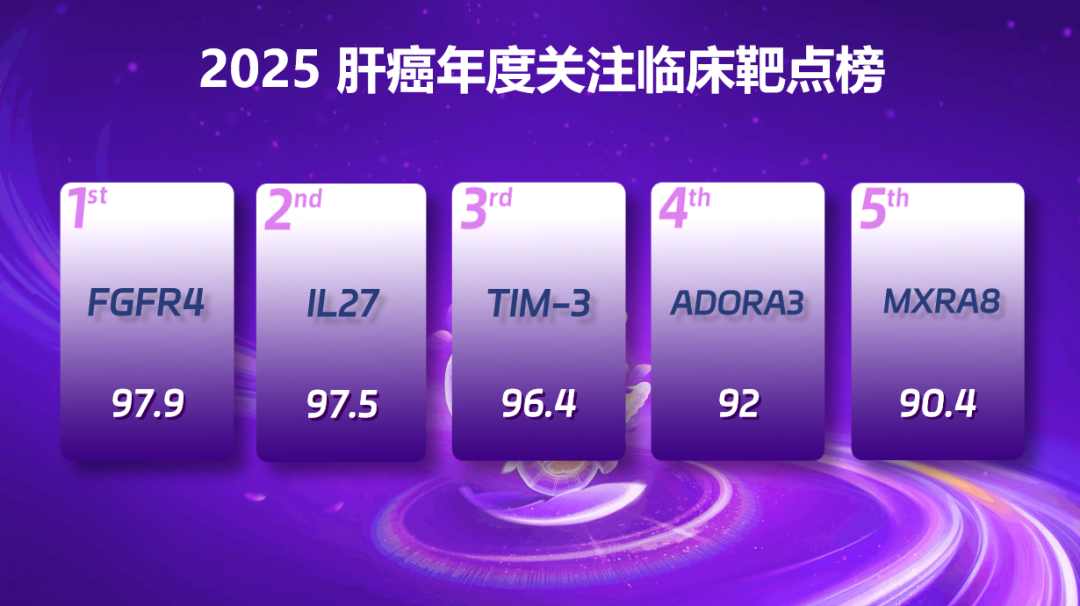
2025 肝癌年度关注临床靶点前五名
第五名:MXRA8(得分:90.40)
MXRA8 是溶瘤病毒 M1(OVM)的特异性受体,溶瘤病毒 M1 通过识别并结合 MXRA8 进入肿瘤细胞发挥溶瘤作用,MXRA8 表达水平直接影响 M1 病毒对肿瘤细胞的杀伤效果。中国学者主导的临床试验显示,溶瘤病毒 M1-c6v1 联合卡瑞利珠单抗与阿帕替尼治疗晚期 HCC,安全性可接受且临床疗效显著,为晚期 HCC 提供了潜在治疗路径,尤其为现有治疗手段有限的患者开辟了新方向。
第四名:ADORA3(得分:92.00)
ADORA3 基因编码的 G 蛋白偶联 A3 腺苷受体(A3AR)在 HCC 等多种实体瘤中过表达,在邻近正常组织中表达量较低。Namodenoson(CF102)是一种高选择性、口服生物利用度良好的 A3AR 激动剂,具备诱导 HCC 细胞凋亡、抑制肿瘤生长及肝脏保护作用。目前,全球多中心 Ⅲ 期临床试验正在开展,有望为合并中度肝硬化的肝癌患者提供潜在治疗方案,同时为 A3AR 激动剂治疗 HCC 积累更深入的研究数据。
第三名:TIM-3(得分:96.40)
T 细胞免疫球蛋白和黏蛋白结构域蛋白 3(TIM-3)在肿瘤微环境多种细胞中均有表达,HCC 等实体瘤组织中 TIM-3 表达上调,且高表达与不良预后相关。2025 年 ASCO 年会公布的多中心、单臂 Ⅱ 期临床研究结果显示,靶向 TIM-3 单抗联合 PD-1 单抗一线治疗不可切除 HCC,可为 Child-Pugh A 级患者提供兼具疗效潜力与可控安全性的治疗选择,为 TIM-3 靶向治疗方案提供了有力的循证支持。
第二名:IL27(得分:95.70)
白细胞介素-27(IL-27)在调节 T 细胞生长分化中发挥重要作用,同时可在肿瘤微环境中增强 CD8⁺T 细胞的持久性与效能。Casdozokitug 是首个且目前唯一处于临床阶段的 IL-27 靶向抗体,Ⅰ 期研究证实其单药或联合 PD-1 单抗具有良好的安全性与抗肿瘤活性。Ⅱ 期试验进一步显示,IL-27 单抗 + 阿替利珠单抗 + 贝伐珠单抗三联方案一线治疗不可切除 HCC,安全性可控且疗效确切,相关拓展临床研究正在推进,有望提供更充分的循证医学证据。
第一名:FGFR4(得分:97.90)
FGF19 阳性(过表达)亚型约占 HCC 总体的 30%,通常伴随不良预后。Ⅰ 期临床试验显示,高选择性 FGFR4 抑制剂 Irpagratinib(ABSK-011)单药治疗 FGF19 过表达晚期 HCC 具有一定疗效,联合阿替利珠单抗可进一步提高客观缓解率。Ⅱ 期研究证实,该抑制剂联合阿替利珠单抗,在初治及免疫检查点抑制剂(ICI)经治的 FGF19 阳性晚期 HCC 患者中均表现出显著抗肿瘤活性,为这类患者带来了新的治疗方向。
随后,大会主席沈锋教授重磅揭晓「2025 胆道癌年度临床热词」。

2025 胆道肿瘤三大年度临床热词
新辅助治疗展露头角
2025 年,可切除胆道恶性肿瘤新辅助治疗研究获重大突破。III 期 AIO/CALGP/ACO - GAIN 研究显示,新辅助吉西他滨 + 顺铂后行根治性肝切除术,较直接手术,R0 切除率显著提高,中位总生存期近乎翻倍。ZSAB - neoGOLP 研究表明,neoGOLP 方案新辅助治疗伴高危复发因素肝内胆管癌(iCCA),中位无事件生存期显著延长,OS 有改善趋势。POLCAGB 研究证实,化疗联合同步放化疗可改善局部晚期胆囊癌患者生存指标,有望实现降期获益。
HER-2 双抗治疗获批上市
2025 年 5 月 27 日,HER2 双特异性抗体泽尼达妥单抗获国家药品监督管理局(NMPA)附条件批准,用于经治 HER2 高表达(IHC3 +)的不可切除局部晚期或转移性胆道恶性肿瘤(BTC)。这是国内首款获批的 HER2 双抗药物,也是首个获批用于胆道癌的 HER2 靶向治疗。基于全球多中心 IIb 期临床试验 HERIZON-BTC-01 数据,该药物为 HER2 阳性 BTC 患者提供了高效且可耐受的新型治疗选择,标志着胆道肿瘤的抗 HER2 治疗证实进入「双抗」时代。
免化联合成为一线标准治疗
TOPAZ-1 研究 3 年随访显示,度伐利尤单抗联合化疗方案治疗不可切或转移性 BTC 患者,3 年 OS 率达单纯化疗组的两倍以上。中国 Topdouble 研究也证实度伐利尤单抗联合多种化疗方案有显著临床获益,与全球研究结果一致。KEYNOTE-966 研究验证了帕博利珠单抗联合 GC 方案改善患者健康相关生活质量(HRQoL)方面的获益。基于此,免疫联合化疗方案被全球主要指南列为晚期胆道癌一线标准治疗方案,为患者带来兼具疗效与安全性的重要治疗选择。

2025 胆道肿瘤年度关注临床研究前五名
第 5 名:HERIZON - BTC - 01(得分:86.80)
HERIZON - BTC - 01 研究是迄今最大规模、随访时间最长的 HER2 靶向治疗 BTC 的临床研究。更新结果显示,总体人群确证性 ORR 为 41.3%,IHC 3 + 亚组 cORR 更高、DCR 更优,中位 DoR、PFS 和 OS 均更长。该研究支持泽尼达妥单抗在中国获批上市,填补了难治性胆道癌精准治疗空白,推动了 HER2 检测规范化应用。
第 4 名:TopDouble(得分:88.50)
开放标签、多中心、单臂 IIIb 期研究 TopDouble 旨在验证度伐利尤单抗联合三种以吉西他滨为基础的化疗方案在晚期不可切除 BTC 患者一线治疗中的安全性与有效性。研究结果与全球 Ⅲ 期研究 TOPAZ - 1 总体趋势一致,为中国晚期胆道癌免疫联合化疗方案提供了有力循证证据。
第 3 名:ProvIDHe(得分:89.00)
基于 III 期 ClarIDHy 研究结果,FDA 批准艾伏尼布治疗 IDH1 突变局部晚期或转移性胆管癌(CCA)适应证。ProvIDHe 是开放标签、国际性、早期准入 IIIb 期研究,纳入最大规模 IDH1 突变 CCA 患者队列。中位治疗持续时间为 2.8 个月,部分患者达到部分缓解,病情控制率较高,中位总生存期为 15.5 个月,6 个月和 12 个月 OS 率分别为 80.3% 和 60%,该研究结果进一步为 ClarIDHy 研究填补了真实世界依据。
第 2 名:POLCAGB(得分:89.50)
III 期随机对照试验 POLCAGB 结果显示,NACRT 组 ORR、R0 切除率显著高于 NACT 组,中位 OS 和中位 EFS 明显延长,该研究充分证实,在化疗基础上联合同步放化疗可显著改善局部晚期胆囊癌(LAGBC)患者的 OS、EFS 及 R0 切除率,新辅助放化疗有望为患者实现降期,并成功将肿瘤缓解转化为生存获益,为 LAGBC 患者的治疗决策提供了重要依据。
第 1 名:ZSAB - neoGOLP(得分:90.80)
ZSAB - neoGOLP 研究是全球首个 PD-1 抑制剂联合靶向治疗和化疗用于可切除、伴高危复发因素肝内胆管癌(iCCA)新辅助治疗的多中心、随机对照 II/III 期研究。中期分析结果显示,与对照组相比,neoGOLP 方案显著延长 EFS,中位 EFS 分别为 18.0 vs 8.7 个月,肿瘤退缩明显,ORR 为 54.5%,MPR 率为 19.3%,OS 有明显改善趋势,为可切除肝内胆管癌患者提供极具潜力的新辅助治疗方案。

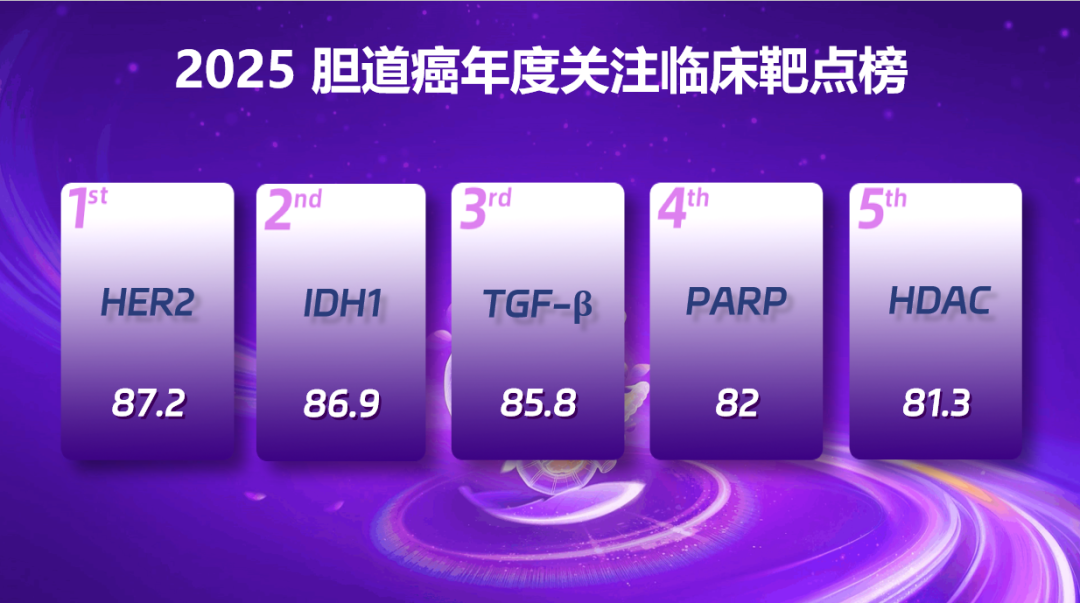
2025 胆道肿瘤年度关注临床靶点前五名
第 5 名:HDAC(得分:81.30)
HDAC 在胆道癌中发挥关键作用,其过表达与患者预后不良相关,HDAC 抑制剂成为潜在靶向治疗选择。B - Enefits/SCOG - B001 研究评估了恩沃利单抗和西达本胺联合 GEMOX 方案一线治疗晚期和转移性胆道癌的疗效和安全性,结果显示该新型组合有临床意义的抗肿瘤活性及可控毒性,为 HDAC 抑制剂治疗胆道癌提供了重要循证医学证据。
第 4 名:PARP(得分:82.00)
高达 60% 的胆道癌患者存在 DNA 损伤修复基因改变,PARP 抑制剂有望成为潜在治疗手段。2025 ESMO GI 研讨会上,单臂 II 期临床研究探索奥拉帕利在特定晚期胆道癌的疗效与安全性,结果显示其有望作为同源重组缺陷(HRD)亚型的晚期胆道癌患者的潜在治疗方案,同时 ,PARP 抑制剂联合其他创新治疗的策略是未来重要探索方向。
第 3 名:TGFβ(得分:85.80)
TGFβ 信号通路失调可驱动肿瘤进展,与患者不良预后和免疫治疗耐药相关。Bintrafusp Alfa 是能同时抑制 TGFβ 和 PD - L1 的双功能融合蛋白,晚期胆道癌一线治疗 II/III 期临床研究中,该药物联合化疗组 ORR 相较单纯化疗组显著改善,但未能转化为 OS、PFS 的显著获益。当前多项探索 TGF-β 联合其他靶点协同抑制的研究正在进行中,未来的研究数据拭目以待。
第 2 名:IDH1(得分:86.90)
IDH1 突变在肝内胆管癌(iCCA)中发生率为 13%-20%,在肝外胆管癌(eCCA)中较为罕见,在胆囊癌(GBC)中发生率极低。III 期 ClarIDHy 试验结果显示,与安慰剂组相比,艾伏尼布组患者中位 PFS 显著延长。基于此,艾伏尼布获 FDA 批准用于此类患者治疗。2025 年,IIIb 期 ProvIDHe 研究揭示了艾伏尼布治疗 IDH1 突变型胆管癌患者的真实世界数据,进一步凸显了 IDH1 靶向治疗在胆管癌领域的重要地位。
第 1 名:HER2(得分:87.20)
HER2 过表达或基因扩增在肝外胆管癌(5%-19%)、胆囊癌(15%-32%)更常见,肝内胆管癌仅 0%-5%。2025 年,HER2 靶向治疗在胆道癌领域取得了显著进展。在双抗治疗方面,泽尼达妥单抗治疗 HER2 阳性经治患者的客观缓解率 41.3%,中位总生存期 15.5 个月;在 ADC 治疗方面,德曲妥珠单抗治疗 HER2 阳性经治患者的中位 PFS 7.4 个月、OS 12.4 个月。HER2 靶向治疗已成为胆道肿瘤精准治疗版图中不可或缺的一环。
大会主席秦叔逵教授重磅揭晓「胰腺癌年度临床热词」。

2025 胰腺癌三大年度临床热词
Claudin18.2 抗体联合化疗未达预期
Claudin 18.2(CLDN18.2)在胰腺导管腺癌(PDAC)中高表达,被认为是 PADC 的潜在治疗靶点。2025 年公布的 II 期 GLEAM 试验数据显示,佐妥昔单抗联合化疗一线治疗 CLDN18.2 阳性转移性 PDAC 未达到 OS 主要终点。尽管结果令人遗憾,但该研究为靶向治疗提供了关键经验,推动了双特异性抗体、CAR-T 等创新策略、以及联合策略的探索,为 CLDN18.2 靶向治疗开辟了新路径。
肿瘤电场(TTFields)治疗胰腺癌取得突破
肿瘤电场(TTFields)作为非侵入物理疗法,通过低强度中频交变电场干扰肿瘤细胞有丝分裂,破坏微管蛋白排列、阻止染色体分离以诱导凋亡。2025 年 ASCO 及 ESMO-GI 两大顶级肿瘤学会议公布 PANOVA-3 III 期研究,证实其联合化疗可延长不可切除局部晚期胰腺癌患者生存期、改善生活质量,是该领域首个获 OS 阳性结果的 III 期研究,标志着物理治疗与化疗的协同模式进入成为潜在标准治疗选择。
KRAS 抑制剂治疗 PDAC 指日可待
KRAS 突变是胰腺导管腺癌(PDAC)最为核心的驱动基因之一,2025 年成为 KRAS 靶向治疗的「突破之年」。中国学者主导的 I/II 期研究显示,KRAS G12D 抑制剂 GFH375 单药治疗晚期 PDAC 的 ORR 达 40.7%,DCR 96.7%;另一项 Ib/II 期研究中,HRS-4642 联合化疗一线治疗初治患者的 ORR 达 63.3%,6 个月 PFS 率 89.3 %。随着 KRAS 抑制剂加速研发,直接靶向 KRAS 突变的治疗策略正从理论走向临床,有望重塑 PDAC 治疗格局。

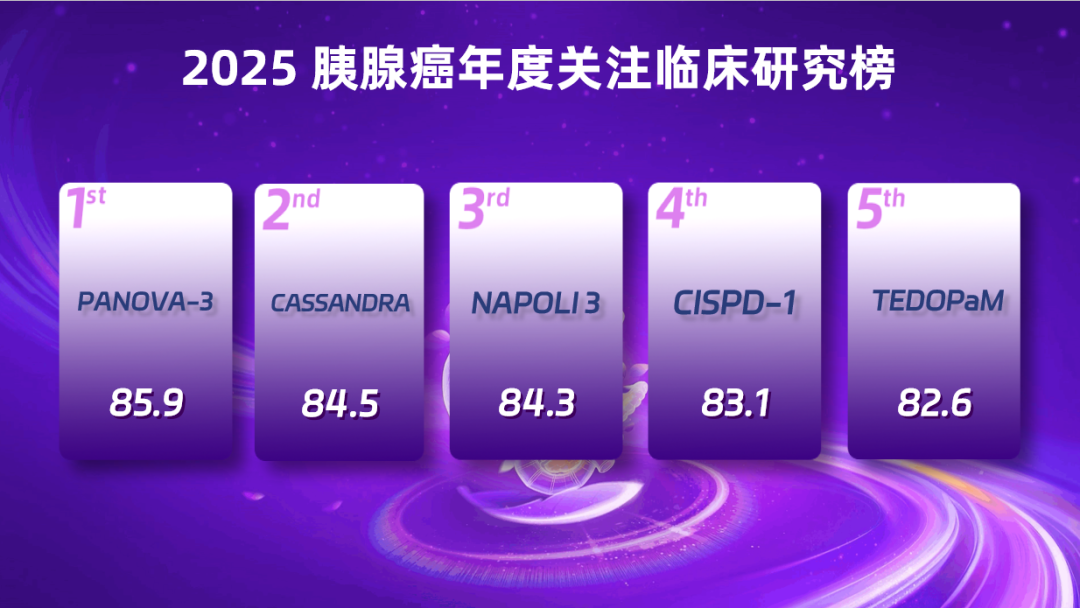
2025 胰腺癌年度关注临床研究前五名
第 5 名:TEDOPaM(得分:82.60)
OSE2101 是一种「现货型」个性化癌症疫苗,由 10 种 HLA-A2 限制性肽组成,靶向 5 种肿瘤相关抗原,或为既往经治胰腺癌患者提供更优替代方案。2025 ASCO 年会上,TEDOPaM 多中心 II 期研究达 OS 主要终点,该研究评估 FOLFIRI 联合或不联合 OSE2101 维持治疗 aPDAC 患者疗效与安全性。结果显示,化疗联合 OSE2101 组 1 年 OS 率达到 65%,中位 OS 和 PFS 分别为 15.5 个月和 7.8 个月,且毒性极低。
第 4 名:CISPD-1(得分:83.10)
CISPD-1 研究于 2025 年 12 月正式见刊国际知名期刊 Cancer Cell,旨在评估序贯新辅助治疗(白蛋白紫杉醇 + 吉西他滨序贯改良 FOLFIRINOX)对比直接手术的疗效与安全性。结果显示,序贯新辅助方案较直接手术显著延长中位 EFS 4.4 个月、中位 OS 8.2 个月,R0 切除率从 79.9% 提升至 87.4%,病理完全缓解率达 60%(直接手术组 <5%),且安全性可控,填补了高危可切除胰腺癌患者新辅助治疗的关键证据缺口。
第 3 名:NAPOLI 3(得分:84.30)
作为前瞻性 III 期研究,NAPOLI 3 对比了 NALIRIFOX 与 Gem + NabP 一线治 mPDAC 患者疗效和安全性,显示 NALIRIFOX 可显著改善患者的中位 OS 和 PFS。基于此,CSCO 和 NCCN 指南均推荐其为 mPDAC 一线标准方案。2025 ASCO 年会以 LBA 形式公布最终 OS 与长生存特征分析,明确了更易从 NALIRIFOX 获益的特定患者人群,为 mPDAC 一线精准治疗积累了有力的循证证据。
第 2 名:CASSANDRA(得分:84.50)
CASSANDRA 研究是可切除及临界可切除 PDAC 术前治疗领域的重要突破。作为 Ⅲ 期随机对照试验,它首次证实术前新辅助治疗中 PAXG 方案比传统 mFOLFIRINOX 方案优势明显,中位 EFS 延长近 6 个月,3 年 EFS 率翻倍,更可提升病理完全缓解率等且安全性更佳。研究采用多中心大样本(261 例)设计,成果在 2025 ASCO 年会以 LBA 公布、获《柳叶刀》刊发,有望确立新标准,填补了该领域 PDAC 新辅助治疗的空白。
第 1 名:PANOVA-3(得分:85.90)
PANOVA-3 是首个在不可切除局部晚期 PDAC 中取得 OS 阳性结果的 III 期试验。TTFields 联合化疗使患者的中位 OS 显著延长(16.2 个月 vs 14.2 个月),排除治疗未满 1 周期患者后,中位 OS 延长更加显著(18.3 个月 vs 15.1 个月),TTFields 联合化疗有望成为不可切除局部晚期 PDAC 一线新标准。
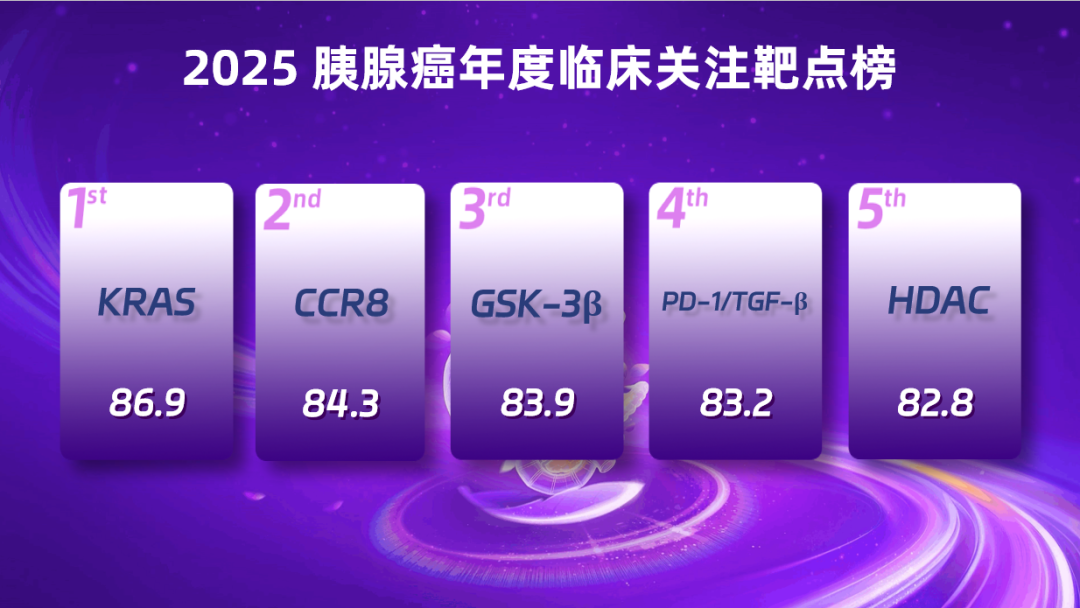
2025 胰腺癌年度关注临床靶点前五名
第 5 名:HDAC(得分:82.80)
HDAC 作为表观遗传调控酶,在 PDAC 细胞中普遍过度表达,抑制 HDAC 可通过恢复促凋亡基因表达等机制发挥抗肿瘤作用。Ⅱ 期临床研究显示,阿得贝利单抗联合西达本胺、S-1(ADEPT 方案)一线治疗局部晚期或转移性 PDAC 的抗肿瘤活性良好,且安全性可控;另一项 Ⅱ 期探索试验中,西达本胺联合恩伐利单抗、S-1 二线治疗晚期/转移性 PDAC 同样显示出良好的疗效与安全性。基于 HDAC 的调控策略前景广阔,HDAC 有望成 PDAC 精准治疗突破点。
第 4 名:PD-1/TGF-β(得分:83.20)
PDAC 肿瘤微环境免疫抑制突出,致密基质与高水平 TGF‑β 信号阻碍免疫细胞浸润,单一 PD‑1/PD‑L1 抑制效果不佳。以 TQB2868、SHR-1701 等为代表的PD-(L)1/TGF-β 创新双功能融合蛋白的疗效及安全性数据提示,PD-(L)1/TGF-β 双抗联合化疗为难治性晚期或转移性 PDAC 提供了潜在的新治疗选择。
第 3 名:GSK-3β(得分:83.90)
糖原合成激酶-3(GSK3)参与细胞增殖、分化与代谢,在特定肿瘤中过度表达。随机 II 期研究结果显示:在 233 例 mPDAC 患者一线治疗中,首创 GSK-3β 抑制剂 elraglusib 联合吉西他滨与白蛋白紫杉醇(GnP),相比单纯 GnP 治疗,患者 1 年 OS 率翻倍,中位 OS 从 7.2 个月延长至 10.1 个月,死亡风险降低 37%。这为靶向 GSK-3β 治疗策略提供循证依据,提示有望成为胰腺癌精准治疗潜在新方向。
第 2 名:CCR8(得分:84.30)
靶向肿瘤浸润性调节性 T 细胞(Tregs)是克服癌症免疫治疗耐药性的潜力策略,LM-108 作为新型 Fc 优化抗 CCR8 单抗,可选择性清除肿瘤浸润性 Tregs、保留外周 Tregs。由中国学者主导的汇总分析纳入两项 I/II 期临床试验,评估其联合抗 PD-1 疗法治疗胰腺癌的疗效与安全性,研究入选 2025 ASCO 年会口头摘要。目前 CCR8 靶向研发不断拓展,全球超 20 款 CCR8 靶向药物在研,作为肿瘤免疫治疗新兴方向,抗 CCR8 单抗有望成胰腺癌精准免疫治疗的重要突破。
第 1 名:KRAS(得分:86.90)
KRAS 是 PDAC 最常见突变基因,2025 年,多款靶向 KRAS G12D 的小分子抑制剂临床研究取得实质进展。除 G12D 靶向药外,国际上泛 RAS(ON)抑制剂进展突出,为「泛 KRAS 抑制」提供关键临床验证。同时,KRAS 靶点治疗模式持续拓展,肿瘤疫苗、PROTAC 新型药物及 ctDNA 动态监测指导的疗效评估与耐药管理等新疗法,正从基础研究迈向临床转化,为 PDAC 精准治疗带来更多可能。
临床决策发布
开模式的第三个环节为「临床决策发布」,本环节由北京大学国际医院梁军教授担任主持嘉宾。

李天天先生依托丁香园平台 100 余万条临床真实提问数据,深度分享了 AI 视角下肝胆胰肿瘤临床决策的核心洞察。他指出,领域核心矛盾在于一线治疗「选择困境」与后线治疗「证据真空」并存,临床诊疗存在十大共性问题与十大核心痛点,集中体现在决策不确定性、安全性管理焦虑等方面。未来需聚焦双抗 / ADC 新型药物、微小残留病灶(MRD)动态监测、AI 多模态辅助诊断等十大研究趋势,以精准分层、技术赋能为核心,破解循证医学与真实世界的实践鸿沟,推动肝胆胰肿瘤全病程精细化、个体化管理。

肝胆胰肿瘤主题演讲
在主题演讲环节,肝癌主题演讲环节由大会主席樊嘉院士担任主持嘉宾。

复旦大学附属中山医院孙惠川教授和中国科学技术大学附属第一医院刘连新教授分别就「2025 年度肝癌重要研究进展」、「未来展望:肝癌治疗挑战与未来」为主题作深入分享。
孙惠川教授在主题演讲中指出,肝癌防治领域正面临严峻挑战,预计未来 30 年全球新发病例与死亡病例将翻倍,且病因谱系从传统「病毒性病因」向「代谢性病因」结构性变迁。在此背景下,中国已实现从「国际规则跟随者」到「防治范式定义者」的跨越,2025 年 The Lancet 发表的中国学者主导全球防治倡议,构建起「预防 - 筛查 - 诊疗 - 管理」全周期战略框架,形成政策引领、学术支撑、技术驱动的三位一体防治新生态。
临床治疗方面,早期可切除肝癌开创「新辅助 + 手术 + 辅助」全新模式,中晚期肝癌推动局部与系统治疗协同,中期 HCC 向「局部治疗+ 系统治疗」模式转型,晚期双免、靶免联合疗法持续优化,个体化精准治疗成为核心趋势。基础研究的持续驱动为临床突破筑牢根基,中国学者在代谢失调相关脂肪型肝炎(MASH-HCC)免疫代谢机制、极早期精准预警、免疫治疗应答与耐药靶点鉴定等领域频发国际顶刊成果,标志着中国科研力量从「跟跑并跑」迈向「并跑领跑」,深度引领全球肝癌诊疗范式变革。

刘连新教授在主题演讲中指出,未来肝癌治疗将迈入「精准 + 免疫 + 技术」深度融合的全新阶段,以个体化、全病程管理为核心导向实现多维突破。
在治疗技术上,研究者应聚焦下一代免疫疗法(含新型免疫检查点抑制剂、双特异性抗体)、靶向 「不可成药」靶点的抗体偶联药物与 KRAS 抑制剂,以及 CAR-T/CAR-NK、TCR-T 等细胞疗法,同时推广溶瘤病毒等新型疗法破解耐药困境;在精准诊疗层面,依托液体活检、MRD 动态监测、AI 多模态辅助诊断等技术,实现早期预警与精准分层,结合基因 / 蛋白组学分析定制专属方案;在诊疗模式上,深化多学科协作(MDT)实体化建设,推广「新辅助 + 手术 + 辅助」的围手术期治疗范式与「局部 - 系统治疗」协同策略,完善从筛查、诊断、治疗到随访的「一站式」全病程管理体系。
这一系列突破正推动肝癌从「绝症」向「慢性病」转变,显著提升患者生存期与生活质量,标志着中国肝癌治疗在原创技术研发、诊疗范式创新等方面持续引领全球进展。

在胆道癌主题演讲环节,大会主席周俭院士担任主持嘉宾。

陆军军医大学第一附属医院(西南医院)梁后杰教授和大会主席沈锋教授分别就「2025 年胆道肿瘤重要年度进展」、「未来展望:胆道肿瘤治疗挑战与未来」为主题作了深入分享。
梁后杰教授在主题演讲中指出,2025 年胆道肿瘤(BTC)领域围手术期治疗方面,ZSAB-neoGOLP 研究证实特瑞普利单抗联合仑伐替尼与化疗的三联新辅助方案,使高危可切除肝内胆管癌患者中位 EFS 达 18.0 个月,疾病复发风险降低 52%;ASCOT 试验等则验证了 S-1 或吉西他滨术后辅助化疗的长期生存获益。靶向治疗迎来突破,HER2 双抗泽尼达妥单抗获 FDA 加速批准、NMPA 附条件批准,IDH1 抑制剂、双特异性抗体联合紫杉醇等方案也展现出良好疗效。此外,III 期研究显示传统化疗强化方案未优于标准双药,进一步凸显精准治疗的重要性。这些进展为 BTC 患者带来更多治疗选择,推动诊疗向规范化、个体化方向迈进。

沈锋教授在主题演讲中指出,BTC 具有高异质性、强侵袭性和差预后特征,全球发病率持续上升,约占消化系统恶性肿瘤的 3%。其病因不明,主要风险因素包括原发性硬化性胆管炎等,病理以腺癌为主,确诊多为晚期,手术切除率约 20%,5 年生存率不足 10%。当前化免方案为治疗基石,TOPAZ-1 研究显示度伐利尤单抗联合 GC 化疗的 4 年 OS 率是单独化疗的近 3 倍,85% 患者获益,局晚期、术后复发等为优势人群,MAGIC-D 评分表可筛选高危患者。
转化治疗能显著提升患者 5 年生存率,但临界可切除定义尚未统一,MDT 介入至关重要,相关研究展现良好转化疗效。二线治疗中,后线靶向治疗死亡风险较化疗降低 60%,多种联合方案提供新选择。未来需推进一线化免治疗精准化、明确转化治疗人群、探索二线新方案,通过多学科协作惠及患者。

在胰腺癌主题演讲环节,傅德良教授担任主持嘉宾。

上海交通大学医学院附属仁济医院王理伟教授和大会主席秦叔逵教授分别就「2025 年胰腺癌重要年度进展」、「未来展望:胰腺癌治疗挑战与未来」为主题作深入分享。
王理伟教授在主题演讲中指出,针对可切除 / 临界可切除胰腺癌,新辅助吉西他滨+ 替吉奥(GS)治疗、白蛋白紫杉醇 + 吉西他滨(AG)序贯 FOLFIRINOX 等方案经 III 期研究证实可显著改善生存,PAXG 方案在无事件生存期(EFS)上优于 mFOLFIRINOX,为治疗模式调整提供循证支持。局部进展期胰腺癌现有化疗、放化疗获益有限,而 PANOVA-3 研究显示,化疗联合肿瘤电场治疗可显著延长生存期,有望重塑其治疗格局。转移性胰腺癌中,AG 方案仍为一线标准,NALIRIFOX 方案对体能良好患者疗效突出,同时靶向 KRAS G12D 等靶点的药物及免疫联合策略正在持续探索中,有望为患者生存改善增添新希望。

秦叔逵教授在主题演讲中指出,胰腺癌作为「癌中之王」,全球发病率持续上升,中国 2022 年新增 11.9 万病例,其「三高三低」(高发病率、高复发转移率、高死亡率,低早期诊断率、低手术切除率、低 5 年生存率)特征显著,5 年生存率不足 5%。当前治疗面临化疗疗效触顶、KRAS 等突变靶点成药难、免疫抑制微环境导致免疫单药无效等困境。然而,研究已现曙光:cfDNA 检测与 AI 影像提升早期诊断灵敏度,国产伊立替康脂质体等化疗方案优化疗效,KRAS G12C/D 抑制剂、CLDN18.2 ADC、NRG1 双抗等靶向药快速迭代,免疫联合策略及肿瘤疫苗、CAR-T 等新型疗法突破瓶颈。未来需依托全基因组测序与多学科协作,推进早诊早治与精准治疗,为患者带来更长生存获益。

上半场大会总结
大会主席秦叔逵教授进行了会议总结:2025 肝胆胰肿瘤年终盘点暨第 2 届临床热词发布会圆满召开,会议揭晓年度热词,CSCO 肝癌专委会、CSCO 胆道肿瘤专委会和 CSCO 胰腺癌专委会携手发力,丁香园团队借助 AI 从 120 万个问题中提炼出临床十大常见问题,获一致认可。六场精彩的主题演讲报道回顾了 2025 年研究进展、展望 2026 年挑战与方向,各位专家的真知灼见为参会者带来深刻启发。秦叔逵教授表示,会议见证了 CSCO 与战略合作伙伴丁香园的长期合作与携手成长,感谢各大合作方及 CSCO 团体会员的支持。未来,CSCO 将继续坚守公益学术初心,重点扶持基层与中青年医生,为中国肝胆胰肿瘤诊疗事业贡献力量。

「临床研究交流会」
除重磅的肝胆胰肿瘤盘点和热词发布活动外,为提高青年医生临床研究见解和认知,大会特携手在肝胆胰肿瘤领域的领军人物共同设置「临床研究交流会」环节。1月24日,大会主席樊嘉院士、秦叔逵教授、周俭院士、沈锋教授发表开场致辞。
樊嘉院士率先发表致辞,对莅临现场的专家同道致以诚挚谢意。他指出,肝胆胰肿瘤兼具高发病率与高死亡率,对高质量临床研究转化及可落地诊疗经验的需求极为迫切。近年来该领域发展势头迅猛,靶向、免疫等关键治疗方向相继取得突破,本土原研药物相关研究成果尤为亮眼。我国学者牵头的多中心研究不仅亮相美国临床肿瘤学会(ASCO)、欧洲内科肿瘤学会(ESMO)等国际顶级肿瘤学盛会,相关成果更获领域顶刊刊登,并被纳入国内外权威诊疗指南。依托海量临床病例储备与多学科协作的突出优势,我国已构建起具有「中国特色」的临床研究体系,实现了从「跟跑」、「并跑」、到部分领域「领跑」的跨越。樊院士表示,未来各方需持续凝心聚力,推动更多创新成果落地临床、造福患者。


随即,秦叔逵教授在致辞中强调,肝胆胰肿瘤异质性强、诊疗难度大,是我国癌症防治的重点与难点。在「健康中国」战略引领下,CSCO 肝癌专委会、CSCO 胆道肿瘤专委会和 CSCO 胰腺癌专委会在指南制定、学术交流等方面成效显著,推动多领域诊疗水平稳步提升。本次交流专场为跨区域、跨学科协作搭建了重要桥梁,助力整合资源、加速成果转化。他坦言,当前领域仍面临肿瘤异质性、早期诊断率低等现实困境,呼吁学界未来加强基础研究、深化多学科协作与国际合作,以患者为中心携手前行。


周俭院士随后致辞,指出肝胆胰肿瘤发病隐匿、恶性度高、诊疗难度大,是临床与科研攻坚的核心领域。近年来,我国依托临床研究实现跨越式发展,靶向、免疫治疗及微创手术持续精进,转化医学的突破更构建起「基础研究 - 临床验证 - 成果转化」的完整闭环,推动诊疗体系全方位高质量升级,中国学者与学术成果在国际舞台的影响力显著提升。他表示,这些成就凝聚着全体同仁的坚守与担当。针对靶点拓展、耐药机制破解等尚未满足的临床需求,未来需强化人才培养、推动高水平转化研究、促进产学研用深度融合,打通成果转化「最后一公里」,让研究切实造福患者。


沈锋教授在致辞中提到,当前肝癌治疗仍面临诸多挑战,但我国早已突破「单纯引进、借鉴国外成果」的阶段,本土药企创新势头强劲,国产原研药物发展迅猛,以中国肝胆胰肿瘤领军人物牵头的学术重要研究成果更是为全球肝胆胰诊疗事业带来了深远而显著的积极影响。他强调,本次会议既是难得的临床研究交流平台,也是对过往一年研究的系统盘点,更是对未来发展的前瞻展望,是绝佳的学习契机。


临床研究交流环节正式开始,由大会主席周俭院士担任主持嘉宾。大会主席樊嘉院士、北京大学肿瘤医院周军教授、复旦大学附属华山医院傅德良教授分别就「肝癌研究经验交流」、「胆道恶性肿瘤研究经验交流」、「胰腺癌研究经验交流」为主题展开临床研究相关的精彩讲课。
大会主席樊嘉院士分享了肝癌治疗从临床困境到研究突破的关键进展。当前全球肝癌疾病负担日趋加重,中国作为肝癌负担最重的国家,面临早期诊断率低、术后高复发率、中晚期治疗响应异质性大及系统治疗耐药等核心挑战。对此,樊嘉院士团队牵头开展多项重磅研究:CARES-009 首创「新辅助 + 手术 + 辅助」的「三明治」围手术期模式,显著延长患者无事件生存期;TALENTOP 以「T+A」 方案推动晚期肝癌转化治疗,为不可手术患者争取根治机会;LEAP-012 的三联方案为中晚期患者带来显著无进展生存期获益,且中国人群疗效更突出。这些研究以临床需求为导向,提供了高等级循证医学证据,推动全球肝癌诊疗范式革新。未来,肝癌治疗将聚焦中国经验主导全球防治纲领、cfDNA 甲基化等早筛技术创新、肿瘤新抗原免疫治疗及肝胆肿瘤综合治疗中心建设,中国正从肝癌研究「执行者」升级为「定义者」与「引领者」,为全球肝癌防治贡献中国策略与方案。

周军教授围绕「胆道恶性肿瘤研究经验交流」进行精彩分享。胆道恶性肿瘤(BTC)作为我国高发病、高死亡率的恶性肿瘤,初诊可根治切除患者仅 20%,5 年生存率约 10%,疾病负担沉重。当前治疗已进入免疫联合 + 精准靶向新时代,围绕 FGFR2、IDH1、HER2、KRAS G12C 等关键靶点,多款在研药物展现亮眼疗效。其中,现有临床数据显示,国产多靶点激酶抑制剂治疗 FGFR 抑制剂耐药患者客观缓解率(ORR)达 30%、疾病控制率(DCR)超 90%,HER2 双抗 - 抗体偶联药物(ADC)特定剂量组下的 ORR 近 60%。双特异性抗体、ADC 药物、肿瘤疫苗等新型疗法的持续探索,真实世界研究的同步推进,为改善患者预后、破解治疗困境提供了多元解决方案。

傅德良教授分享了胰腺癌诊疗的最新研究进展与实践突破。胰腺癌作为「早期诊断率低、手术切除率低、五年生存率低」,且「发病率高、复发转移率高、死亡率高 」的恶性肿瘤,其全球及中国发病率持续攀升,死亡发病比超 0.94,术后复发转移率达 69%~80%,诊疗面临全流程挑战。针对这一现状,当前已形成多维度创新突破:AI 辅助诊断技术实现早期筛查与精准分期,可切除胰腺癌从「手术优先」转向「新辅助治疗优先」,临界可切除 / 局部进展期患者通过放化疗联合肿瘤电场治疗提升转化切除率;手术治疗中联合血管切除显著改善生存,微创与开放手术疗效无显著差异;药物治疗方面,一线 NALIRIFOX 方案、中国人群专属的二线伊立替康脂质体联合 5-FU/LV 方案,以及局部进展期化疗联合肿瘤治疗电场成为关键突破,围术期通过胰肠吻合优化、营养支持等措施严控并发症风险。此外,典型转移性胰腺癌患者经「化疗 + 手术 + 维持治疗」实现 40 个月超长生存期,印证了多模式联合诊疗的临床价值。未来胰腺癌诊疗将持续聚焦精准分层与个体化治疗,以技术创新与临床研究推动患者生存获益进一步提升。

以「临床研究发展现状分析与讨论」为题的圆桌讨论由大会主席秦叔逵教授担任主持嘉宾。樊嘉院士、周俭院士、沈锋教授、周军教授、傅德良教授以及四川大学华西医院曹丹教授针对关键性问题展开精彩讨论。

01
问题一:过去中国肝胆胰肿瘤研究最大的短板,是「问题来源」而不是 「技术能力」。在当前 CARES-310、CARES-009、TALENTOP 等原创研究已具国际影响力的背景下: 未来 5 年,中国研究者应优先定义的「全球尚未解决的核心问题」 是什么?
★ 沈锋教授:
▶ 从外科视角看,肝胆胰肿瘤研究核心抓手为早期诊断,这是根治性切除的前提,也是与内科形成「诊-治-愈」闭环的关键。当前国内乙肝感染患者的自我知晓率仅 30%-40%,远低于世卫组织 2030 年 80%-90% 的目标,需强化科普推广,同时结合现有标志物推进精准早筛与手术适配分层。此外,个体化治疗精准匹配是重点,需兼顾疗效、并发症、生活质量与经济成本。学科深度融合是研究突破关键,后续应持续协同推进早诊早治与精准匹配落地。
02
问题二:转化治疗已成为中国肝癌研究的标志性优势,但现实中存在「过度转化」与「无效手术」的风险。您认为未来必须通过哪些生物标志物 / 动态评估体系,才能真正筛选出「值得转化」的患者? 当前临床决策更多依赖经验,是否已经到了必须建立标准化预测模型的阶段?
★ 周俭院士:
▶ 转化治疗是我国肝胆胰肿瘤诊疗的标志性优势。从 20 世纪 70-80 年代的二步肝切除、肝动脉结扎化疗(转化切除率不足 20%),到如今靶免联合介入 / 局部治疗,众多晚期患者实现转化并获得长期生存,疗效突破显著。但临床存在过度转化与无效手术问题:部分患者转化达标未及时手术,或过度治疗引发耐药、血管闭塞;复杂血管侵犯患者术后生存期极短,手术无实际意义。因此,转化治疗需把握时机,达标即手术,稳定期结合放疗优化;更需内外科精准协作,合理分流患者,避免过度转化与无效手术。
★ 樊嘉院士:
▶ 我国肝癌患者多为中晚期、无法一期切除,转化治疗是核心方向。上世纪 80 年代,吴孟超院士、汤钊猷院士等前辈已探索介入、核素放疗等转化方案,相关研究聚焦转化切除率、生存期与复发率等核心指标,但受限于缺乏系统治疗药物,疗效有限。2008 年酪氨酸激酶抑制剂问世后,因缺乏联合治疗设计,转化率一直难以突破。临床中过度转化问题突出,TALENTOP 研究初步证实转化达标后及时手术,疗效优于持续系统治疗。此外,影像学完全缓解(CR)患者术后包膜下仍有残存癌细胞,是复发根源,需更多临床研究优化策略。
03
问题三:BTC 是当前「靶点最多的消化道肿瘤之一」,FGFR2 融合、IDH1 突变、HER2 扩增、BRAF 突变、MSI-H...... BTC 靶点非常丰富,但整体疗效提升仍有限。目前,靶向治疗真正改变人群预后的比例仍极低。是否意味着 BTC 的真正驱动机制并未被找到? 还是当前的临床试验设计低估了联合策略的重要性?
★ 周军教授:
▶ BTC 并非单一疾病,而是由多样病因、驱动基因和流行病学特征构成的疾病群,无统一核心驱动基因,这是其异质性的核心所在,也决定了诊疗与研究不能一概而论。在以免疫治疗为基础的方案成为治疗标准的背景下,不同 BTC 细分人群的免疫或靶向治疗获益差异尚无统一答案,需针对性分析。部分靶点如 BRAF、HER2 突变患者靶向疗效显著,其围手术期、维持治疗及一线二线策略均与未突变 BTC 患者截然不同,也让联合治疗设计更具挑战。BTC 精准诊疗的核心难点是异质性,但中国的精准检测已走在世界前列,不仅患者检测可及性高,CSCO 胆道专委会制定了精准检测专家共识,为临床诊疗和研究奠定了坚实基础。
04
问题四:如果让您下注未来 10 年胰腺癌最可能带来真实生存突破的方向,您会选择什么? 哪一个最可能率先改变生存曲线?
★ 曹丹教授:
▶ 胰腺癌 5 年生存率仍未突破 10%,但临床研究与实践已有新进展。分子检测已成常规,KRAS G12C 抑制剂等方案可及,中国 KRAS 靶向研发领先,相关研究成果显著且多款药物进入 III 期临床。精准分层是未来关键,Claudin 18.2、HER2 靶向药提供更多可能,亦应关注 EGFR ADC 联合治疗潜力。目前正借鉴胆管癌经验开展的索凡替尼联合 PD-1 抑制剂、化疗的 III 期免疫联合研究正在进行中,期待实现突破。
★ 傅德良教授:
▶ 胰腺癌术前常规 MRI/CT 存在局限,部分医疗中心使用全身 CT 提供更全面评估,国外海量影像资料虽有参考性但筛选难度大。针对影像学隐匿转移,可结合 癌胚抗原(CEA)等肿瘤指标行 PET-CT,以检出远处淋巴结、肺内微小结节,经济条件允许时建议采用。局部进展期伴血管侵犯患者新辅助 / 转化治疗后,推荐 PET-CT 排除转移再手术更稳妥。需注意 PET-CT 阴性仍可能存在无高代谢微小转移,双靶点 FDG 检测可减少漏判,避免无效手术。
★ 秦叔逵教授:
▶ 本次讨论中,各位专家分享了肝胆胰肿瘤研究进展与经验,内容极具启发。当前学科边界已打破,不再局限于内外科区分,而是趋向专病导向的多学科协作,融合内外科、放疗等多个领域的综合诊疗能力。肝胆胰肿瘤诊疗发展态势逐渐清晰:肝癌「一马当先」,胆管癌「紧随其后」,胰腺癌「虽处突破前夜,但曙光已现」。Claudin 18.2 相关药物临床研究失败,不代表靶点或药物本身无效,临床中已有该靶点药物使患者获益的案例,相关联合治疗研究也在推进。相信未来的研究将为肝胆胰肿瘤精准诊疗提供更好的循证证据。
沈锋教授对本次临床研究交流会进行了总结性发言。临床研究交流会是 2025 肝胆胰肿瘤年终盘点暨第 2 届临床热词发布会的会前预热活动。本次会议中,领域大咖与中青年专家齐聚一堂、各抒己见,围绕关键议题深入研讨,凝聚发展共识,为肝胆胰肿瘤学科的创新突破注入强劲动力。

此外,本次大会同期举办了「践行指南,肝胆肿瘤标准诊疗专场」,并开设四场专题论坛,进一步深度探讨了基于指南的肝胆肿瘤诊疗策略与思路。
临床经验交流会
1 月 25 日下午,临床经验交流会正式召开。大会主席沈锋教授针对「临床经验交流会」环节进行致辞。他强调,作为严重威胁人类健康的重大疾病,肝胆胰肿瘤我国防治形势严峻,诊疗工作仍面临医疗资源区域与层级分布不均、疾病异质性显著、规范化诊疗水平待提升等核心难题。在「健康中国」战略的引导下,近些年来,医保政策不断优化,药物可及性不断增强,MDT 协作模式普遍推广,科研领域新药与技术领域迎来重大突破。本次会议为与会者搭建了学术交流的重要平台,助力分享经验与成果、探讨诊疗难题,旨在提升行业水平,推动协作,共促我国肝胆胰肿瘤防治事业发展。

在肝癌病例分享环节,中国科学技术大学附属第一医院荚卫东教授担任大会主持嘉宾。

东部战区总医院王碧波教授针对「如何改造肝脏肿瘤免疫微环境 LUMINATE 研究」进行两则局部肝癌的病例分享。一例为 66 岁男性、乙肝 + 脂肪肝 + 酒精肝(MAFLD 背景)、CNLC IIb 期 / BCLC A 期的 10.5 cm 单发巨大寡病灶肝癌(AFP 正常、PIVKA-II 显著升高),另一例为 54 岁男性、乙肝相关、CNLC IIA 期 / BCLC B 期的 8×8 cm 主灶合并肝内多发转移灶的多灶肝癌(AFP 轻度升高、PIVKA-II 明显升高),二者均通过局部治疗(TACE、SBRT)与免疫 / 靶向系统治疗(多纳非尼 + PD-L1 抑制剂)的深度协同成功创造手术窗口。
前者采用「TACE + 多纳非尼序贯 SBRT+PD-L1 抑制剂」策略实现高质量转化,顺利完成 R0 根治性切除,病理提示无卫星灶、MVI 0 级、Ki-67 低表达,术后持续辅助治疗体现全程管理思路,为 MAFLD 背景巨大单灶 HCC 提供有效方案,后者通过动态调整的联合治疗转化后,采用「肝癌切除术 + 射频消融术」覆盖多灶病灶,术后延续系统治疗,验证了该模式对 BCLC B 期多灶肝癌的局部控制价值,两例均印证了局部治疗重塑免疫微环境与系统治疗放大效应的协同理念,为不同特征肝癌的转化治疗提供了重要临床参考。

随后,浙江省肿瘤医院应杰儿教授、中山大学附属第一医院许丽霞教授、复旦大学附属中山医院蔡加彬教授作为该病例讨论专家,就 AI 基于该病例生成的问题展开联合讨论。

01
问题一:病例 1 中,患者合并 MAFLD + 乙肝 + 酒精肝背景,AFP 阴性、PIVKA-II 显著升高,肿瘤直径 >10 cm。在 MAFLD 通常被认为「免疫治疗获益受限」的前提下,该病例仍获得显著转化并取得低侵袭性病理结果。您认为其「破局点」最可能在于哪一层面?
★ 应杰儿教授:
▶ 免疫治疗作为肝癌内科治疗基石,进一步提升疗效的核心路径包括精准人群选择(如 dMMR/MSI-H 患者)与联合增效,其中联合模式更易实现预期疗效。肝癌治疗手段丰富,除全身治疗外,TACE、放疗、溶瘤病毒等局部治疗的联合应用已成热门研究方向,且在多瘤种中证实可发挥 「1+1>2」 的协同效果。LUMINATE 研究的「TACE + 短程 SBRT + 靶免」组合设计颇具探索价值,虽目前病例数有限,但已显现良好近期疗效。该病例的成功得益于多手段联合的「加法策略」,为初诊局部晚期肝癌患者带来治疗模式革新,提示临床需重视多学科整合,通过多模式联合促进肿瘤退缩、争取手术机会,最终助力患者获得远期生存获益。
02
问题二:病例 2 为 BCLC B 期,多灶病变(主灶 + 肝内小转移灶),最终采用「切除 + 射频消融」的组合手术方式。如果该患者在联合治疗后影像学仍存在多个 ≤1 cm 的残留灶,您更倾向于如何处理?
★ 蔡加彬教授:
▶ 在临床实践中,对于病灶数量>4 个的肝癌患者,目前多优先选择系统治疗,外科手术应用较少。这一现状与当前患者对施行手术的高度期待密切相关:临床常将外科手术等同于「根治性治疗」,对其创伤、围手术期风险及术后短期复发的容忍度较低,而放疗、介入等局部治疗则被默认作为「姑息减瘤手段」,要求相对宽松。随着药物治疗的进步,外科的角色正迎来理念革新 —— 未来外科或可成为治疗链中的关键环节,无需追求 100% 根治,只需解决 80% 左右的肿瘤负荷,剩余病灶交由药物、放疗等协同控制,同样有望显著延长患者总生存期。但目前,因同行认同度不足、医疗纠纷风险等顾虑,外科医生极少尝试减瘤手术。此外,AI 技术的普及也给临床带来新挑战,患者常因 AI 建议与医生方案不一致而反复咨询,占用有限门诊时间,进一步制约了临床探索的灵活性。
03
问题三:结合这两个病例,您如何看待在当前 MAFLD 时代背景下,通过局部治疗与系统治疗的「时序设计」,重塑肿瘤免疫微环境并实现高质量转化切除?在真实世界中,您最关注哪些关键决策点?
★ 许丽霞教授:
▶ 我国肝癌患者仍以乙肝相关为主,但随着生活水平提升,MAFLD 相关或乙肝合并 MAFLD 背景的肝癌病例日益增多。这类患者的肿瘤多为「冷肿瘤」,免疫治疗疗效受限,如何实现「冷转热」成为临床探索重点。现有研究表明,局部治疗(介入、放疗、消融等)可释放肿瘤抗原,抗血管生成治疗能促进
编辑:Bree
| 分享到: |
上一篇 下一篇
