1 月 5 日,默沙东宣布,全球首个且目前唯一突破性疗法激活素信号传导抑制剂(ASI)欣瑞来®(注射用索特西普,Sotatercept)在国内获批上市,适用于治疗 WHO 功能分级(FC)II-III 级的肺动脉高压(PAH,WHO 第 1 组)成年患者,以改善患者的运动能力和 WHO 功能分级。
值得一提的是,这是默沙东曾于 2021 年度斥巨资 115 亿美元收购 Acceleron,囊获这一核心管线。

截图来源:企业官微
Sotatercept 是一种 first-in-class 激活素受体型 IIA(ActRIIA)融合蛋白,通过结合激活素配体 TGF-β 亚家族成员,来阻断其与 ActRIIA 受体的结合,从而抑制 ActRIIA-Smad2/3 信号通路,改善促增殖和抗增殖信号之间的平衡来调节 PAH 背后的血管细胞增殖,达到抑制肺血管重塑的效果。
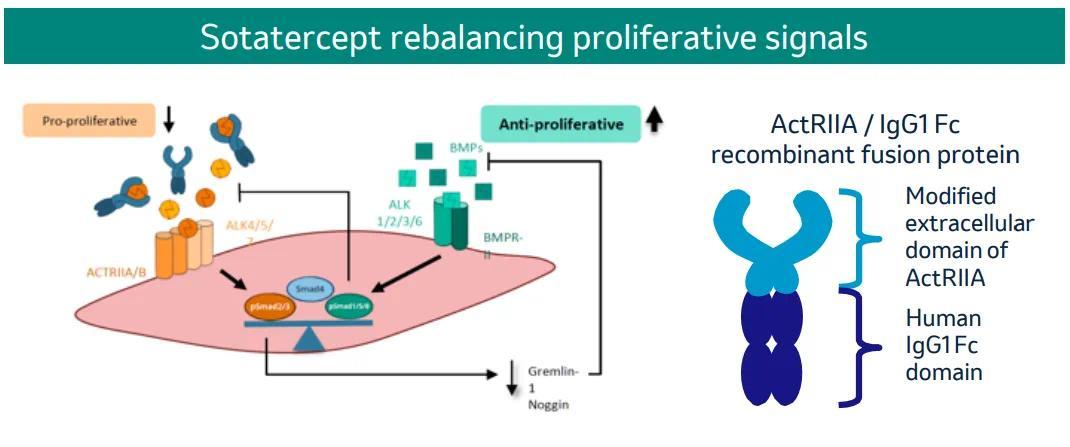
截图来源:默沙东官网
据 Insight 数据库显示,Sotatercept 最早于 2024 年 3 月在美国实现全球首次获批,商品名为 Winrevair,同年又在欧盟获批上市。2024 年度,商业化不足一年,该药就已实现 4.19 亿美元全球销售额;2025 Q2 仅单季度就实现 3.36 亿美元销售成绩,几乎在上市第二年就锁定了「十亿美元重磅炸弹」席位,足见其商业化潜力。
2025 年度,Sotatercept 在全球继续攻城略地,6、7 月份已经在日本、韩国陆续获批。本次在华获批,意味着该药已经成功登陆全球各大医药市场。
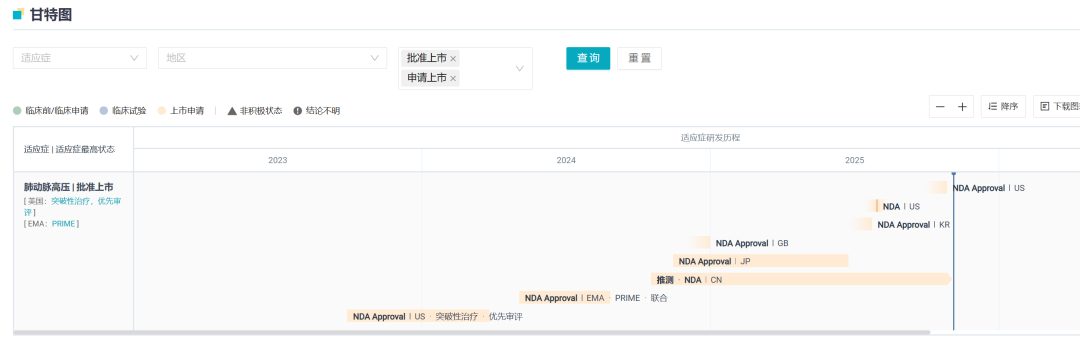
Sotatercept 全球申报获批情况 截图来自:Insight 数据库
Sotatercept 此前在 FDA 的获批是基于 STELLAR 研究的结果(NCT04576988)。这是一项随机、双盲、安慰剂对照、多中心关键 III 期临床研究,旨在评估与安慰剂相比 Sotatercept 与稳定背景治疗联用在成人肺动脉高压的有效性和安全性。
试验入组了 323 位 WHO 功能分级为 II-III 级的 PAH 患者(不包括与门脉疾病、血吸虫病、HIV 感染或肺静脉闭塞病)。所有患者在入组前至少接受了 90 天 PAH 的背景治疗(包括单药、双联或三联治疗),并在整个试验期间继续接受背景治疗。
入组患者按 1:1 的比例随机分配接受皮下注射 Sotatercept 或安慰剂治疗 24 周。试验的主要终点是第 24 周 6 分钟步行距离相对于基线的变化,次要终点有 9 个,包括总体情况改善、肺血管阻力改变、WHO 功能分级改善等。
结果显示,在第 24 周时,Sotatercept 治疗组患者 6 分钟步行距离比基线增加了 41 米(95% CI:28, 54;p<0.001;安慰剂调整),并显著改善了多个重要的次要结果指标,包括与单独使用背景疗法相比,因任何原因死亡或 PAH 临床恶化事件的风险降低了 84%。
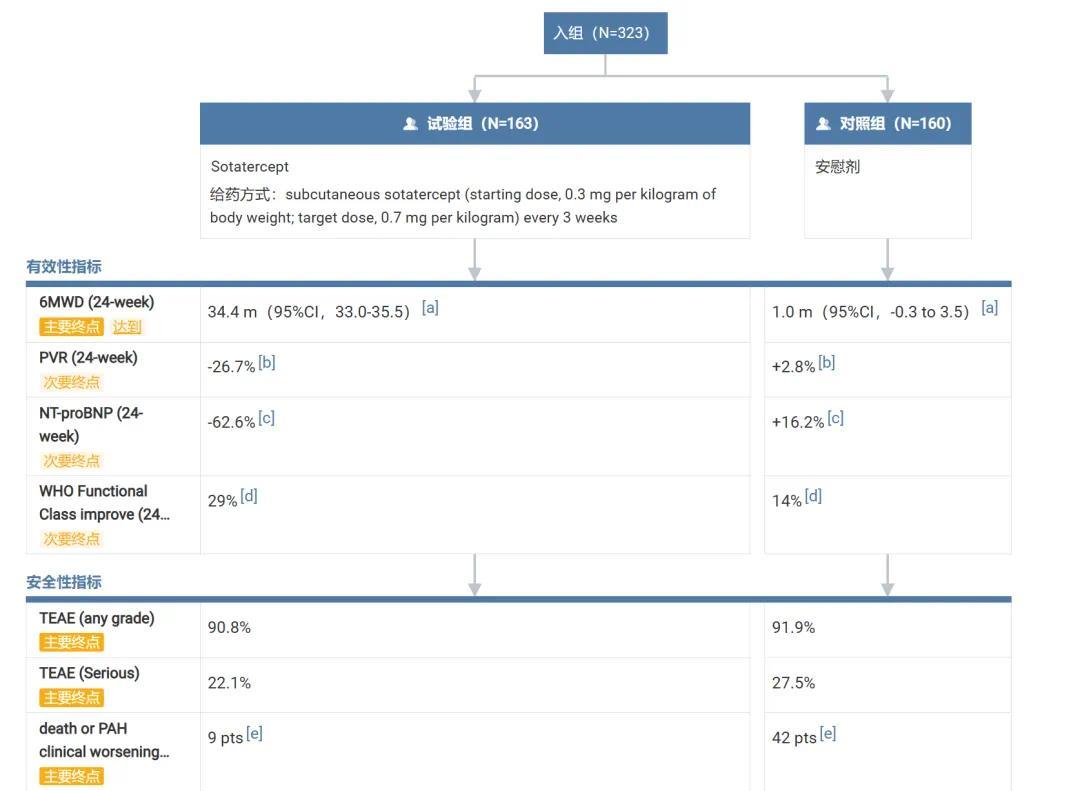
Sotatercept 关键临床试验结果 截图来自:Insight 数据库
除 STELLAR 研究之外,默沙东还开展了多项 III 期临床,并陆续取得积极结果。
如 2025 年 3 月公布结果的 ZENITH 研究,针对处于最高死亡风险的 PAH 患者(FC III/IV 级)将临床恶化事件风险降低 76%,因疗效优异而提前终止。2025 年 10 月 FDA 已经基于该积极结果批准 Sotatercept 适应症扩大至降低临床恶化事件(因 PAH 住院、肺移植和死亡)风险。
此外,如 9 月在 NEJM 上重磅发表的 HYPERION 研究,聚焦 12 个月内新诊断为 PAH(FC II/III 级)、具有中危或高危疾病进展风险的成人患者,临床恶化事件风险显著降低 76%。
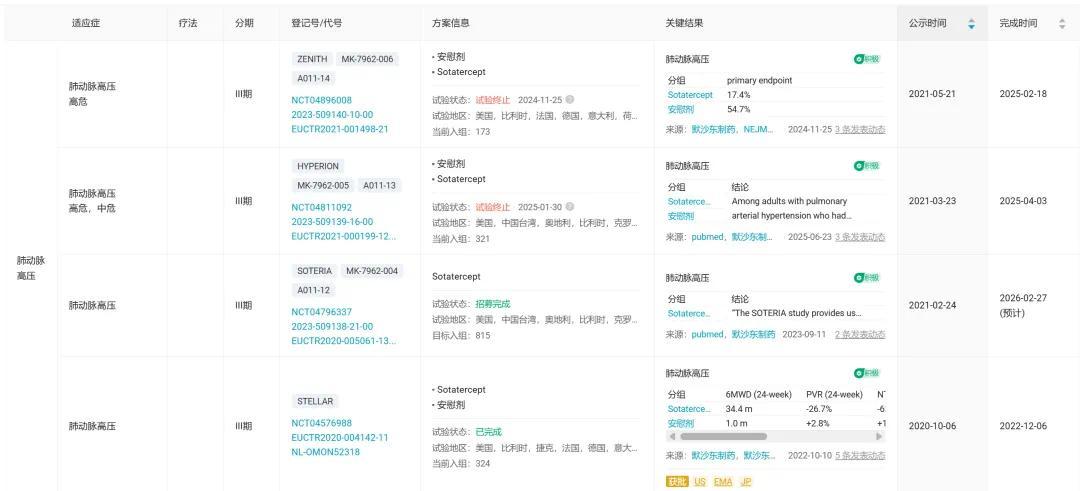
已公布结果的积极 III 期关键临床研究 截图来自:Insight 数据库
PAH 是一种罕见且通常迅速进展的疾病。该病是由于促进和抑制增生信号的不平衡导致肺动脉壁的血管增厚,控制血流,使得右心室负担日益加重,最终引起心力衰竭甚至死亡。据 Insight 统计,2023 年全球 PAH 患病率为 15/百万。
对比传统的靶向治疗药物,Sotatercept 的另一个优势在于,其给药方式为皮下注射,只需每三周进行一次注射。并且在后续治疗中,患者可脱离医生指导,自行在家完成药物注射 。而现有的 PAH 靶向药物,仍需每日、长期服药。Sotatercept 的获批不仅使患者得以获得新治疗方案,也有望大大减轻医生和患者的负担。
编辑:ccai
编辑:ccai
