《CSCO胰腺癌诊疗指南》是中国临床肿瘤学会(CSCO)发布的权威指南,为胰腺癌的诊断和治疗提供最新的建议和指导。该指南基于最新的临床研究和实践经验,不断更新,以确保提供最前沿的治疗策略。
2024年4月26日-27日,由中国临床肿瘤学会(CSCO)和北京市希思科临床肿瘤学研究基金会联合主办的2024 CSCO指南会在济南召开。新版《CSCO胰腺癌诊疗指南》尤为引人瞩目。
病理部分-免疫和靶向精准治疗
注释内容更新:
对于dMMR/MSL-H胰腺癌患者,靶向PD-1可能获益,普通患者目前免疫治疗尚无充分循证医学证据,建议参加临床研究。
靶向NRG1、NTRK、BRAF V600E、KRAS G12C、KRAS G12D建议参加临床研究。
对于存在BRCA1/2或PALB2突变的患者,推荐含铂类方案化疗。
胚系存在BRCA1/2突变患者,接受铂类为基础的化疗方案16周仍稳定患者,推荐奥拉帕利维持治疗(POLO研究,1A类,Ⅰ级推荐)。
转移性胰腺癌一线治疗


GEM+白蛋白结合型紫杉醇I级推荐(1A类)
证据来源:
MPACT(Ⅲ期临床研究):861例转移性胰腺癌患者,随机接受白蛋白结合型紫杉醇联合GEM或GEM单药治疗。结果显示,使用GEM+白蛋白结合型紫杉醇患者的mOS为8.7个月,GEM单药组的6.6个月(P<0.001),两组差异有统计学意义。在转移性胰腺癌初治患者中,GEM联合白蛋白结合型紫杉醇的mOS较GEM单药明显延长,且耐受性良好。该研究人群胰腺为高加索人群,但在国内已广泛使用,故作为I级推荐。
FOLFIRINOX方案I级推荐(1A类)
证据来源:
奥沙利铂+伊立替康+5-FU/亚叶酸钙联合方案(FOLFIRINOX):324例PS 0~1分转移性胰腺癌患者,随机采用FOLFIRINOX或GEM方案,比较并评估其疗效。FOLFIRINOX组的mOS为11.1个月,GEM组为6.8个月(P<0.001)。与GEM治疗相比,FOLFIRINOX方案的毒性反应发生率较高,是体力状况良好的转移性胰腺癌患者的治疗选择之一。该研究人群为高加索人群,但在国内已广泛使用,故作为I级推荐。
GEM联合尼妥珠单抗(KRAS野生型)I级推荐(1A类)
证据来源:
2022年ASCO年会报道的NOTABLE随机对照双盲Ⅲ期临床研究显示:针对KRAS野生型患者,与GEM单药相比,GEM联合尼妥珠单抗组的OS延长显著,分别为10.9个月和8.5个月(P=0.024),mPFS分别为4.2个月和3.6个月(P=0.013),尼妥珠单抗联合治疗不显著增加不良反应发生。此研究为Ⅲ期临床研究,入组患者为中国人群,且为生物标志物指导下的治疗,获益明确,故作为I级推荐。
NOTABLE研究是一项前瞻性、随机双盲、阳性药平行对照、全国多中心的关键性III期临床研究,创新性地采用分子生物标志物筛选富集人群。从2015年4月至2020年9月,共25家大型中心共同参与,筛选了480例,随机入组92例KRAS基因野生型的局部晚期或转移性胰腺癌患者。以1:1随机分为两组,试验组接受尼妥珠单抗(400mg,每周1次)+吉西他滨( 1000mg/m2,第1、8、15天,每4周1个疗程),直至疾病进展或发生无法耐受的不良事件,对照组接受安慰剂+吉西他滨。主要研究终点为总生存期(OS),关键次要终点为无进展生存期(PFS),其他次要终点包括客观缓解率(ORR)、疾病进展时间(TTP)和安全性等。
研究结果显示,在全分析集中,试验组的中位生存期(mOS)较对照组显著延长(10.9 vs.8.5个月,P=0.024,HR=0.5,95%CI,0.06-0.94),即死亡风险降低50%。试验组的1年生存率为43.6%和3年生存率为13.9%,而对照组分别为26.8%和2.7%。
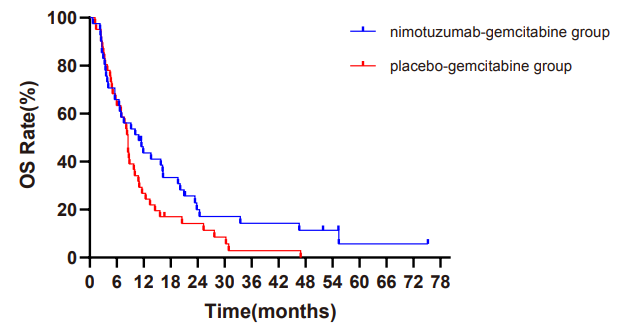
NOTALBE研究全分析系集人群总生存期曲线图
在关键次要终点方面,试验组的中位无进展生存期(mPFS)也较安慰剂组明显延长(4.2 vs.3.6个月,HR=0.56; 95%CI, 0.12-0.99; P=0.013),其中未接受胆道梗阻处理患者的mPFS 分别为5.5 vs.3.4个月; P=0.008)。同时,试验组拥有优良的安全性,加用尼妥珠单抗的试验组不良反应率与安慰剂组相似,最常见的3级不良反应是中性粒细胞减少症(11.1%)、白细胞减少症(8.9%)和血小板减少症(6.7%),未见4级及以上的不良反应。
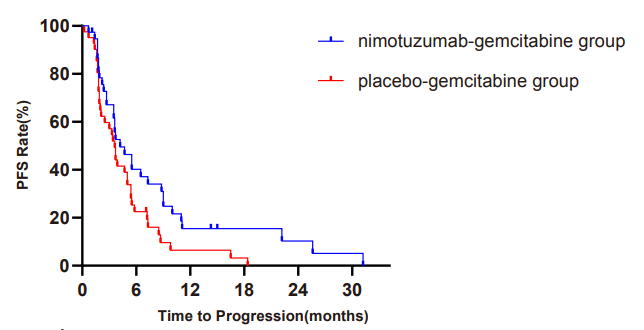
NOTABLE研究全分析系集人群无进展生存期曲线图
2023年8月31日,全球顶级肿瘤期刊美国《临床肿瘤学杂志》(Journal of Clinical Oncology,JCO)在线发表该研究的主论文。


Ⅱ级推荐新增NALIRIFOX方案 (1A类)
更新理由和证据来源:
NAPOLI-3研究是一项随机、开放标签、III期临床研究,纳入确诊的既往未治疗的转移性胰腺导管腺癌(mPDAC)患者,随机分配接受NALIRIFOX方案或吉西他滨+白蛋白紫杉醇方案治疗,研究主要终点为OS。结果显示吉西他滨+白蛋白紫杉醇治疗组相比,接受NALIRIFOX方案的患者在OS(11.1 vs. 9.2个月)和无进展生存期(PFS,7.4 vs. 5.6个月)方面均显示出统计学的显著差异。两组的安全性一致,总体可控。需要指出的是,NAPOLI-3研究目前缺乏来自中国大陆人群的数据。
Ⅲ级推荐新增AG方案序贯mFOLFOX-6方案 (2A类),并更新相关注释。
更新理由和证据来源:
SEQUENCE研究是一项开放标签、随机、II期、研究者主导的临床试验,旨在评估一线治疗方案在mPDAC患者疗效和安全性。本研究纳入了ECOG性能状态评分为0-1的mPDAC患者。参与者随机分配接受吉西他滨+白蛋白紫杉醇方案或吉西他滨+白蛋白紫杉醇序贯mFOLFOX方案。主要终点是12个月的OS率。
研究结果显示吉西他滨+白蛋白紫杉醇序贯mFOLFOX组的PFS为7.9个月,显著优于吉西他滨+白蛋白紫杉醇组的5.2个月;中位OS分别为13.2个月和9.7个月,差异均具有显著统计学意义,且序贯治疗方案安全性良好。结果证明吉西他滨+白蛋白紫杉醇序贯mFOLFOX作为一线治疗方案在mPDAC患者中具有显著的临床疗效。
小结
当前,胰腺癌治疗仍然以化疗为主,针对靶向治疗的临床证据尚显不足,但相关临床研究已在进行中。期待在不久的将来,能够看到更多基于临床研究的高质量数据发布,以进一步指导和优化胰腺癌精准治疗策略。
编辑:ifhealth 来源:医事药闻
