来自华盛顿大学医学院的 Joy Snider 教授对阿尔茨海默病(AD)的新兴治疗策略进行了详细梳理。她从 AD 的新定义入手,强调了这一疾病从无症状期到症状出现并逐渐加重的动态发展过程。接着,她介绍了三种新型 β-淀粉样蛋白(Aβ)免疫疗法的临床试验成果,并讨论了仑卡奈单抗(Lecanemab)在临床实践应用中的表现。最后,她指出了关于这些药物使用悬而未决的问题。
一
AD 定义为疾病诊断连续谱
AD 以进行性加重的认知和行为障碍为临床特征,以脑内 Aβ 沉积和 tau 蛋白过度磷酸化为特征性病理表现。Aβ 在大脑中的沉积被认为是 AD 的关键病理事件,这一病理改变往往早于症状出现约 10 - 20 年。
AD 定义的新概念,指代表了突触和神经元退化连续过程的一种神经退行性脑疾病, 而不论是否存在临床症状[1]。需注意将 AD 诊断观念转变为认识到该疾病是一个连续体,而非孤立症状的实体,图 1。它两个有主要阶段,分别为(1)临床前期 AD,又称无症状期,现有的临床方法,如神经心理测验无法检测到明显的认知功能改变,但可通过影像、血液和体液检测到生物标志物的变化;(2)症状性 AD,以认知功能下降为其特征,认知障碍的程度涵盖从轻到重,进而影响日常生活的能力。根据症状的严重程度,这一阶段又可细分为前驱期(即轻度认知障碍期)和痴呆期。
AD 生物标志物在无症状的早期 AD 诊断中起核心作用,已经被整合进临床诊断标准并被广泛用于临床试验。这些生物标志物的变化表现出一种动态的进程。初始阶段,患者尚无临床症状时脑脊液(CSF)中的 Aβ 水平下降以及 amyloid-PET 扫描显示淀粉样蛋白负荷增加。随后,tau 蛋白异常磷酸化以及 FDG-PET 扫描的变化将相继出现。在疾病的晚期,结构性脑萎缩如皮层萎缩和海马体体积减小成为显著特征[2, 3]。
神经心理学测试是 AD 重要的辅助诊断工具,临床痴呆评定量表(CDR)因应用广泛而成为评估痴呆程度的关键参考。CDR 得分范围从 0 至 3,其中 1、2 和 3 分别对应痴呆的不同阶段,CDR 得分从另一角度反映了临床症状的演变。

图 1. AD 连续谱可以从临床前 AD 到严重 AD 痴呆的不同阶段;每个阶段的命名在不同的研究组织中有所不同,该图总结了 AD 的不同命名惯例[4]
二
淀粉样蛋白免疫疗法
(一)阿杜那单抗
阿杜那单抗(Aducanumab)是第一个被美国食品药品管理局(FDA)加速批准用于 AD 的新药。其临床试验验证了 AD 疾病修饰治疗(DMT)在清除淀粉样蛋白方面的效率,并且二期临床试验的数据揭示了该清除作用与临床获益之间的关联,因而引起了极大地轰动。然而,在随后的三期试验中,由于预先设定的效果分析显示试验成功率低,该试验于 2019 年 3 月被提前终止,仅原计划的 55.2%的患者完成了试验[5]。
之后部分数据的重新分析提示该药物可能有效,进而向 FDA 再次提交了加速批准的申请并得到意外批准。然而,围绕这一药物是否应被批准用于临床治疗,医学界展开了广泛的争论。药物的有效性,以及是否涉及不公正利益的问题,成为讨论的焦点。值得注意的是,FDA 在加速批准该药物时,并未得到神经科医生的同意票,而且在实际医疗中,由于数据有限,阿杜那单抗并未得到医生的广泛认可与应用。之后,Biogen 进行了大量的研究,在今年 1 月,他们决定停止该药物的所有商业化活动。
(二)仑卡奈单抗
与阿杜那单抗不同的是,仑卡奈单抗的试验完成了整个研究,并且试验分析结果达到了大部分主要终点,于 2023 年 1 月获得了 FDA 的加速批准,并于 2023 年 7 月获得了全面批准。Clarity AD(双盲、随机、安慰剂对照、Ⅲ 期临床试验)共纳入 1 795 名参与者,以 1:1 比例随机接受仑卡奈单抗(每 2 周一次)或安慰剂治疗。
近期研究结果公布,Clarity AD 达到主要终点,亚组(698 名参与者)达到关键性次要终点,18 个月时意向分析结果显示仑卡奈单抗用药组 CDR-SB 得分比安慰剂组降低 0.45 分,认知能力下降减缓了 27%,可持续减少大脑中的 Aβ 沉积和 tau 聚集[6]。用药组最主要的不良反应是输液反应达 26%,程度是轻度至中度。淀粉样蛋白相关成像异常脑水肿(ARIA-E) 发生率为 12.6%,通常在 4 至 16 周后得到缓解,载脂蛋白 E4 基因(ApoE4)携带者 ARIA-E 发生率为 15.8%[7]。
(三)多奈单抗
多奈单抗(Donanemab),另一种靶向大脑淀粉样斑块的抗淀粉样蛋白抗体,在早期 AD 患者中也显示出了临床获益(TRAILBLAZER-ALZ 2,n=1736)[8],并于2023 年 7 月 6 日获得 FDA 加速批准,目前尚未获得正式批准。与仑卡奈单抗的给药方案不同,多奈单抗采用每月一次的输注方式,这为患者带来了不同的治疗体验。
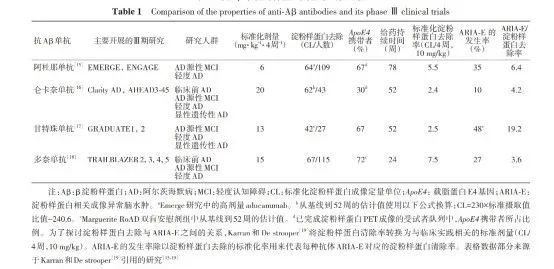
在整体人群和低或中度 tau 病理患者(主要关注的研究人群)中用药组显著减缓了 AD 的临床和病理进展,其中低或中度 tau 病理沉积患者 17.5 个月治疗延缓疾病进展达 35.1%,高度 tau 病理沉积患者的获益程度较低中度患者减低,这突显了早期启动治疗的重要性[8]。24%的多奈单抗组患者出现了 ARIA-E,15.9%出现 ARIA-H,8.7%出现输注反应[8]。以往有 4 种 Aβ 抗体被发现可以促进 AD 患者大脑中淀粉样斑块的清除。关于伦卡奈单抗和多奈单抗的特性以及临床试验结果的对比可参见表 1[9]。
表 1. 抗 Aβ 单抗的特性及其临床试验比较
三
淀粉样蛋白免疫疗法的临床实践
Joy Snider 教授介绍了华盛顿大学 Knight/ADRC 中心使用仑卡奈单抗的经验。适应症与临床试验的纳入指标基本相似,但也有更适用临床患者的改良。纳入患者要求
(1)非常轻微至轻度 AD,CDR 为 0.5~1,简明精神状态测验(MMSE)分数 ≥ 22,对于失语症患者有例外,(2)实验室常规血液检查,(3)淀粉样蛋白沉积的证据,包括 PET、CSF 或可靠的血液标志物。主要改良的地方是对于失语症患者 MMSE 得分要求放宽,Aβ 阳性允许有可靠的 AD 血液标志物。主要排除标准包括 4 及以上个微出血、严重白质高信号、不能完成 MRI、不稳定合并症等。但对于需要口服抗凝药的患者暂不排除,而是由负责治疗的医生酌情决定。
患者在使用免疫疗法的安全性是首先需要关注的。Knight/ADRC 中心会鼓励患者做 ApoE 检查,评估 ARIA 风险。定期进行MRI检查并且由经验丰富的放射科医生读片对 ARIA 进行监测同样重要。基线的 MRI 是监测的前提,除基线外,MRI 必须在第五次、第七次和第十四次输注之前的特定时间点进行。以往有患者在接受伦卡奈单抗治疗后使用 t-PA 治疗出现多发性脑出血的状况[10]。针对正在接受伦卡奈单抗治疗的患者,如果医生开出了 t-PA 或其他溶栓药的处方,中心医嘱系统将自动弹出提示,要求联系中风神经病学专家进行咨询。
四
一些悬而未决的问题
►1. 目前,关于患者需持续使用伦卡奈单抗的确切时间仍有待研究进一步明确。伦卡奈单抗的临床试验为期 18 个月,随后进入了开放标签延期阶段,而多数参与者继续使用该药物。相比之下,多奈单抗的试验在 18 个月后停药,之后对参与者进行了为期 1 年的 PET 随访,其结果尚待公布。基于目前的预测,淀粉样蛋白在被清除后可能会再次积累,但这一过程可能需要数年的时间。因此,确定这些药物的最佳治疗时长需要更多研究和观察。
►2. 在社区使用这些新型抗 AD 药物对社区医生和内科医生来说是一项挑战,如何使得更多人了解这些新药、使得相关群体的临床医生掌握其管理及副作用处理的经验仍在探索阶段。
►3. 在处理非典型 AD 或伴有小血管疾病负担的患者时,是否可以应用新药,应做出何种调整?
►4. 是否允许患者在不同的淀粉样蛋白抗体治疗间切换,目前还没有明确的指导方案。
►5. 关于是否严格遵循 MMSE 分数大于等于 22 分作为药物使用适应症的标准,应综合考量患者个体状况,尤其是失语症患者。
审核专家:复旦大学附属华山医院神经内科 郁金泰 教授
本文首发于丁香园旗下专业平台:丁香园神经时间
本文整理|黄钰媛
本文审核|郁金泰
题图|站酷海洛
编辑:ifhealth 来源:丁香园
